题目内容
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为
根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4
(2)元素S的最高正价和最低负价分别为
(3)用电子式表示二氧化碳分子的形成过程:
考点:元素周期表的结构及其应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:(1)由N元素在周期表中的位置可知,处于第2横行、15列;同主族自上而下,非金属性减弱,非金属性越强,最高价含氧酸的酸性越弱;
(2)最高正化合价=族序数,最低负化合价=族序数-8;
(3)二氧化碳属于共价化合物,分子中C原子与O原子之间形成2对共用电子对,所有原子的最外层都满足8电子结构,用C原子、O原子的电子式表示其形成.
(2)最高正化合价=族序数,最低负化合价=族序数-8;
(3)二氧化碳属于共价化合物,分子中C原子与O原子之间形成2对共用电子对,所有原子的最外层都满足8电子结构,用C原子、O原子的电子式表示其形成.
解答:
解:(1)由N元素在周期表中的位置可知,处于第2横行、15列,故N元素处于第二周期ⅤA族;
同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3AsO4<H3PO4,
故答案为:第二周期ⅤA族;<;
(2)S元素处于ⅥA族,硫元素的最高正价=族序数=+6,最低负价=族序数-8=6-8=-2,
故答案为:+6;-2;
(3)二氧化碳属于共价化合物,分子中C原子与O原子之间形成2对共用电子对,所有原子的最外层都满足8电子结构,用C原子、O原子的电子式表示其形成为: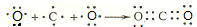 ,
,
故答案为: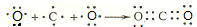 .
.
同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3AsO4<H3PO4,
故答案为:第二周期ⅤA族;<;
(2)S元素处于ⅥA族,硫元素的最高正价=族序数=+6,最低负价=族序数-8=6-8=-2,
故答案为:+6;-2;
(3)二氧化碳属于共价化合物,分子中C原子与O原子之间形成2对共用电子对,所有原子的最外层都满足8电子结构,用C原子、O原子的电子式表示其形成为:
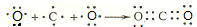 ,
,故答案为:
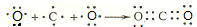 .
.
点评:本题考查位置结构性质的关系及应用,难度不大,注意掌握电子式表示物质的形成或化学键的形成过程.

练习册系列答案
相关题目
现有常温下的四份溶液:①0.01mol?L-1 CH3COOH;②0.01mol?L-1 HCl;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②③混合,若有pH=7,则消耗溶液的体积:②>③ |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D、将①④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
 如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.
如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质. B.
B.

