题目内容
15.下列说法正确的是( )| A. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| B. | 镀锡铁皮的镀层损坏后,铁更容易腐蚀 | |
| C. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| D. | 钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-═4OH- |
分析 A、形成原电池后的装置中,负极金属易被腐蚀,正极金属被保护;
B、形成原电池后的装置中,负极金属易被腐蚀,正极金属被保护;
C、金属原子失去电子,化合价升高,在反应中被氧化;
D、金属的吸氧腐蚀中,负极上是金属失电子的氧化反应.
解答 解:A、镀锌铁皮的镀层损坏后,会形成原电池,金属铁是正极,被保护,不容易腐蚀,故A错误;
B、镀锡铁皮的镀层损坏后,会形成原电池,金属铁是负极,容易腐蚀,故B正确;
C、金属腐蚀就是金属原子失去电子被氧化的过程,故C错误;
D、钢铁吸氧腐蚀时,正极反应式为:2H2O+O2+4e-═4OH-,负极上是Fe-2e-=Fe2+,故D错误;
故选B.
点评 本题考查学生金属的腐蚀和防护知识,注意原电池原理的应用以及金属腐蚀的实质,属于教材知识的考查,难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
6.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4中含有的C原子数目为NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,所含Cl-个数为NA |
3.下列实验操作中正确的是( )
| A. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
10.下列说法正确的是( )
| A. | 反应能否自发进行与温度无关 | |
| B. | 能自发进行的化学反应,一定是△H>0、△S>0 | |
| C. | 放热反应一定都是自发的 | |
| D. | 电解池的反应不属于自发过程 |
4.下列在指定溶液中的各组离子,一定能够大量共存的是( )
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
 X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是
X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是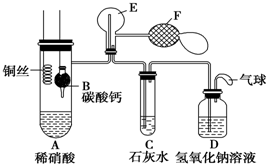 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.