题目内容
关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是( )
| A、原子半径:Na<Cl |
| B、电子数:F-<Mg2+ |
| C、热稳定性:HF>HCl |
| D、碱性:NaOH>Mg(OH)2 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A、同周期从左到右原子半径逐渐减小;
B、根据离子的电子排布分析;
C、元素的非金属性越强,则氢化物的稳定性越强;
D、元素的金属性越强,对应最高价氧化物水化物的碱性越强.
B、根据离子的电子排布分析;
C、元素的非金属性越强,则氢化物的稳定性越强;
D、元素的金属性越强,对应最高价氧化物水化物的碱性越强.
解答:
解:A、同周期从左到右原子半径逐渐减小,则原子半径:Na>Cl,故A错误;
B、F-和Mg2+的核外电子排布相同,核外均有10个电子,则电子数:F-=Mg2+,故B错误;
C、非金属性:F>Cl,元素的非金属性越强,则氢化物的稳定性越强,所以热稳定性:HF>HCl,故C正确;
D、元素的金属:Na>Mg,金属性越强,对应最高价氧化物水化物的碱性越强,则碱性:NaOH>Mg(OH)2,故D正确;
故选CD.
B、F-和Mg2+的核外电子排布相同,核外均有10个电子,则电子数:F-=Mg2+,故B错误;
C、非金属性:F>Cl,元素的非金属性越强,则氢化物的稳定性越强,所以热稳定性:HF>HCl,故C正确;
D、元素的金属:Na>Mg,金属性越强,对应最高价氧化物水化物的碱性越强,则碱性:NaOH>Mg(OH)2,故D正确;
故选CD.
点评:本题考查了元素周期律,熟悉非金属元素和金属元素的性质变化规律及非金属性的比较方法即可解答,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
 已知可逆反应aA(g)+bB(g)?cC(g),体系中A、C的浓度随温度的变化曲线如下图1所示,下列说法不正确的是( )
已知可逆反应aA(g)+bB(g)?cC(g),体系中A、C的浓度随温度的变化曲线如下图1所示,下列说法不正确的是( )| A、该反应于T2温度时曾达到过化学平衡 |
| B、该反应正反应是放热反应 |
| C、T1、T3时正反应和逆反应速率相等 |
| D、该反应的速率随温度的变化情况可用上图2表示 |
下列关于试剂保存方法的叙述错误的是( )
| A、氢氧化钠固体保存在配有橡皮塞的广口瓶中 |
| B、碳酸钠盛放在配有玻璃塞的细口瓶中 |
| C、金属钾浸没在盛有煤油的广口瓶中 |
| D、硝酸密封在盛满棕色的细口瓶中 |
某工业生产经过以下转化步骤:
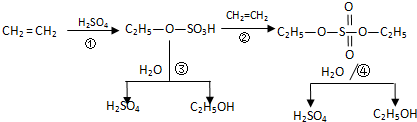
下列说法中不正确的是( )

下列说法中不正确的是( )
| A、该过程中③、④是酯类的水解反应 |
| B、该过程中硫酸是催化剂 |
| C、该过程中①、②是加成反应 |
| D、该过程是一种新的硫酸生产方法 |
水资源非常重要,联合国确定2003年为国际淡水年.下列方法中可以用来进行海水淡化的是( )
| A、过滤法 | B、蒸馏法 |
| C、分液法 | D、萃取法 |
下列物质所属的类别及其所含官能团的对应关系错误的是( )
A、CH3CH=CH2 烯烃  |
B、 醛类-CHO 醛类-CHO |
C、 羧酸-COOH 羧酸-COOH |
| D、RCH2OH(R,烃基) 醇类-OH |
下列反应为氧化还原反应的是( )
| A、HCl+NaOH═NaCl+H2O |
| B、2H2+O2═2H2O |
| C、CaO+H2O═Ca(OH)2 |
| D、CaCO3═CaO+CO2 |
为达到下列实验目的,所采用的方法正确的是( )
| A、分离饱和食盐水和沙子的混合物------过滤 |
| B、分离水和汽油的混合物------蒸馏 |
| C、从硝酸钾和氯化钾混合液中获取硝酸钾-----蒸发 |
| D、从溴水中提取溴------分液 |
 (4)
(4) (5)CH3Cl
(5)CH3Cl  (7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3
(7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3