题目内容
3.关于1mol•L-1Na2SO4溶液的下列说法中,正确的是( )| A. | 溶液中含有1mol Na2SO4 | B. | 1mol Na2SO4溶于1L水中 | ||
| C. | 溶液中c(Na+)=2 mol•L-1 | D. | 1L溶液中含有2molNa+,2mol SO42- |
分析 结合n=cV及物质的构成计算.
解答 解:A.V未知,不能计算1mol•L-1Na2SO4溶液的物质的量,故A错误;
B.1L水为溶剂的体积,不能计算浓度,故B错误;
C.1mol•L-1Na2SO4溶液,c(Na+)=2 mol•L-1,故C正确;
D.1L溶液中含有1mol Na2SO4,则含有2molNa+、1mol SO42-,故D错误;
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握体积、浓度与物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.

练习册系列答案
相关题目
20.下列有关化学用语表示正确的是( )
| A. | 过氧化钠的电子式: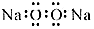 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: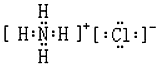 | D. | 硫离子的结构示意图: |
11.在80℃时,将0.40mol的N2O4气体充入1L固定容积的密闭容器中发生反应:N2O4?2NO2(△H>0),每隔一段时间对容器内的物质进行测定,得到如下数据:
(1)在4s-8s之间,用N2O4表示的平均反应速率为0.02mol•L-1•s-1.
(2)在80℃时该反应的平衡常数K=3.6mol/L.
(3)要增大该反应的平衡常数,可采取的措施有④(填序号).
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至20s后若降低温度,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(5)反应进行至20s后若向容器中再充入0.40mol的N2O4气体,则达到新平衡后N2O4的转化率将减小(选填“增大”、“减小”或“不变”).
| 时间(s) | 0 | 4 | 8 | 12 | 16 | 20 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)在80℃时该反应的平衡常数K=3.6mol/L.
(3)要增大该反应的平衡常数,可采取的措施有④(填序号).
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至20s后若降低温度,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(5)反应进行至20s后若向容器中再充入0.40mol的N2O4气体,则达到新平衡后N2O4的转化率将减小(选填“增大”、“减小”或“不变”).
18.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)=2NH3( g)△H=-92.4kJ•mol-1)
请写出下列物理量的关系:
(1)浓度c1与c2c1=c2 2c2与c32c2<c3
(2)能量a与ba+b=92.4 2b与c2b>c
(3)压强p1与p2p1=p2 2p2与p32p2>p3
(4)转化率α1与α2α1+α2=1 α2与α3α2>α3.
(已知N2(g)+3H2(g)=2NH3( g)△H=-92.4kJ•mol-1)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
(1)浓度c1与c2c1=c2 2c2与c32c2<c3
(2)能量a与ba+b=92.4 2b与c2b>c
(3)压强p1与p2p1=p2 2p2与p32p2>p3
(4)转化率α1与α2α1+α2=1 α2与α3α2>α3.
8.由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-.将该混合物溶于水后得澄清溶液,现取3份 100mL该溶液分别进行如下实验:
已知加热时NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O,回答下列问题:
(1)判断混合物中Cl-是否一定存在否.(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度:c(SO42-)=0.1mol/L、c(CO32-)=0.2mol/L、c(NH4+)=0.4mol/L、c(K+)≥0.2mol/L.
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
(1)判断混合物中Cl-是否一定存在否.(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度:c(SO42-)=0.1mol/L、c(CO32-)=0.2mol/L、c(NH4+)=0.4mol/L、c(K+)≥0.2mol/L.
13.常温常压下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(Fe3+)=0.1 mol/L溶液中:Na+、NH4+、SCN-、SO42- | |
| B. | 能溶解CaCO3的溶液中:Fe3+、Ca2+、Cl-、NO3- | |
| C. | 由水电离出的c(H+)=1×10-2mol/L的溶液中:Na+、Ba2+、HCO3-、Cl- | |
| D. | 强碱性溶液中:K+、Na+、ClO-、I- |