题目内容
在一种能使pH试纸变红色的溶液中,下列离子因发生氧化还原反应而不能大量共存的是( )
①Ag+、Na+、Al3+、Cl-
②Fe2+、NO3-、Cl-、Na+
③K+、Mg2+、CH3COO-、SO42-
④K+、H+、SO32-、I-
⑤Na+、NO3-、SO42-、I-.
①Ag+、Na+、Al3+、Cl-
②Fe2+、NO3-、Cl-、Na+
③K+、Mg2+、CH3COO-、SO42-
④K+、H+、SO32-、I-
⑤Na+、NO3-、SO42-、I-.
| A、②⑤ | B、①②④ |
| C、②③⑤ | D、全部 |
考点:离子共存问题
专题:离子反应专题
分析:离子之间发生氧化还原反应,则溶液中应存在强氧化性和强还原性离子,且能发生氧化还原反应,以此解答.
解答:
解:能使pH试纸变红色的溶液呈酸性,
①Ag+、Cl-发生反应生成沉淀,为复分解反应,故错误;
②酸性条件下,Fe2+、NO3-发生氧化还原反应而不能大量共存,故正确;
③酸性条件下CH3COO-不能大量共存,生成弱电解质,没有发生氧化还原反应,故错误;
④H+、SO32-不能大量共存,生成二氧化硫气体,没有发生氧化还原反应,故错误;
⑤酸性条件下NO3-、I-发生氧化还原反应而不能大量共存,故正确.
故选A.
①Ag+、Cl-发生反应生成沉淀,为复分解反应,故错误;
②酸性条件下,Fe2+、NO3-发生氧化还原反应而不能大量共存,故正确;
③酸性条件下CH3COO-不能大量共存,生成弱电解质,没有发生氧化还原反应,故错误;
④H+、SO32-不能大量共存,生成二氧化硫气体,没有发生氧化还原反应,故错误;
⑤酸性条件下NO3-、I-发生氧化还原反应而不能大量共存,故正确.
故选A.
点评:本题考查离子共存问题,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意题目发生氧化还原反应的要求,把握常见离子的性质以及反应类型的判断,难度不大.

练习册系列答案
相关题目
下列装置图及有关说法正确的是( )
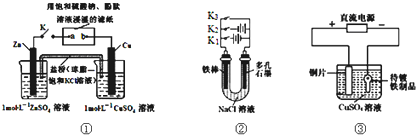

| A、装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 |
| B、装置①中K键闭合时,片刻后可观察到滤纸a点变红色 |
| C、装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 |
| D、装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA |
下列说法正确的是( )
| A、1g钠投入100g水中,溶液的总质量为100g |
| B、1g表面被氧化的金属钠投入100g水中,溶液的总质量为101g |
| C、1g氧化钠投入100g水中,溶液的总质量为101g |
| D、1g过氧化钠投入100g水中,溶液的总质量为101g |
节能减排,作为我国“十一五”规划中一重要任务,已不仅是政府的一个行动目标,而且还能给企业带来经营上的收入,让城市居民能获得一个较好的生存环境.节能减排更是一个人类解决环境问题的必经之路.下列措施和节能减排无关的是( )
| A、将白炽灯换成节能灯 |
| B、发展利用新能源,如太阳能、氢能、核能等 |
| C、大力植树造林,增加绿色植被 |
| D、少开汽车,采取骑自行车或做公交车 |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、100mL lmol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1NA |
| B、7.8 g Na2O2中含有的离子总数目为0.4NA |
| C、30g SiO2晶体中含有Si-O键的数目为2NA |
| D、1 L 0.1 mol/L NaHCO3溶液含有0.1nA个HCO3- |
将0.1mol?L-1HCN溶液与等体积等浓度的NaCN溶液混合,溶液显碱性,下列关系不正确的是( )
| A、c(Na+)>c(CN-)>c(OH-)>c(H+) |
| B、c(CN-)<c(HCN) |
| C、c(CN-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(CN-)+c(OH-) |
同质量的下列烃,分别在氧气中充分燃烧,消耗氧气最多的是( )
| A、甲烷 | B、乙炔 | C、丙烯 | D、甲苯 |
下列化学反应达到平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
| A、SO2(g)+NO2(g)?SO3(g)+NO(g) (正反应为放热反应) |
| B、C(s)+CO2(g)?2CO(g) (正反应为吸热反应) |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
| D、H2S(g)?H2(g)+S(s) (正反应为吸热反应) |