题目内容
2.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 压缩容器体积平衡向正反应方向移动,达到新的平衡后c(A2)变小 | |
| C. | 平衡后加入A2,达到新的平衡A2 和B2的转化率均增大 | |
| D. | 达到平衡后,降低温度或增大压强都有利于该反应平衡正向移动 |
分析 对于反应A2(g)+2B2(g)?2AB2(g)△H<0,正反应为放热反应,升高温度,平衡逆向移动,反应物气体的计量数之和大于生成物,则增大压强,平衡正向移动,以此解答该题.
解答 解:A.升高温度,正逆反应速率都增大,故A错误;
B.压缩容器体积平衡向正反应方向移动,但因体积减小,则达到新的平衡后c(A2)增大,故B错误;
C.平衡后加入A2,达到新的平衡A2 的转化率减小,B2的转化率增大,故C错误;
D.正反应为放热反应,降低温度,平衡正向移动,反应物气体的计量数之和大于生成物,则增大压强,平衡正向移动,故D正确.
故选D.
点评 本题考查化学平衡的影响因素,为高频考点,侧重考查学生的分析能力,把握温度、压强、催化剂对反应速率及平衡的影响即可解答,注意催化剂不能改变△H为解答的易错点,题目难度不大.

练习册系列答案
相关题目
11.可逆反应mA(s)+nB(g)?pC(g)+qD(g),在反应过程中,当其他条件不变时,C的百分含量(c%)与温度(T)压强(P)的关系如图,下列叙述正确的是( )

| A. | 达到平衡后,加入催化剂则c%增大 | |
| B. | 该反应的△H<0 | |
| C. | 化学方程式中n>p+q | |
| D. | 达到平衡后,增加A的量有利于平衡向正反应方向移动 |
12.蓄电池在放电时起原电池的作用,在充电时起电解池的作用.下面是某蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2下列有关该蓄电池的推断错误的是( )
| A. | 放电时,Fe是负极,NiO2是正极 | |
| B. | 蓄电池的电极可以浸入某中酸性电解质溶液中 | |
| C. | 充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- | |
| D. | 放电时,电解质溶液中的阴离子向负极方向移动 |
9.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-丙基辛烷 的名称为2,4-二乙基-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立体结构)有15种 | |
| D. | 某有机物的结构简式是  ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 |
7.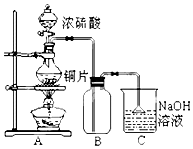 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000mL,取20.00mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是不能,pH>5时,铜离子与碱反应生成沉淀,不能达到滴定终点.
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
14.25℃时,某气态烃与O2混合充入密闭容器中,点燃爆炸后又恢复至25℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空.该烃的化学式可能为( )
| A. | CH4 | B. | C2H4 | C. | C3H6 | D. | C4H10 |
12.下列气态氢化物最稳定的是( )
| A. | HF | B. | HCl | C. | H2S | D. | HI |