题目内容
8.由铜片、锌片和100mL稀硫酸溶液组成的原电池中,当铜片上产生6.72L(标态)气体时,硫酸恰好作用完:(1)写出正负极的电极反应式.
(2)计算该反应转移电子的物质的量.
(3)计算原稀硫酸溶液的物质的量浓度.
分析 (1)铜片、锌片和100ml稀硫酸组成原电池,金属锌是负极,负极上发生氧化反应,铜是正极,正极上发生还原反应;
(2)根据氢气与电子的关系式计算;
(3)根据氢气与硫酸的关系计算硫酸的物质的量,再根据物质的量浓度公式计算其浓度.
解答 解:(1)铜片、锌片和100ml稀硫酸组成原电池,金属锌是负极,铜是正极,原电池的两个电极发生的电极反应是:正极:2H++2e-=H2↑,负极:Zn-2e-=Zn2+,
答:正极反应为2H++2e-=H2↑、负极反应为Zn-2e-=Zn2+;
(2)设转移电子z,则
Zn+H2SO4=ZnSO4+H2↑ 转移电子
22.4L 2mol
6.72L z
所以z=0.6mol
答:有0.6mol电子通过了导线;
(3)设硫酸的物质的量为y.
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
y 6.72L
所以y=0.3mol
C=$\frac{n}{V}$=$\frac{0.3mol}{0.1L}$3mol/L
答:原稀硫酸溶液的物质的量浓度3mol/L.
点评 本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量间的关系是解本题的关键,难度中等.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
16.能发生消去反应,生成物中不存在同分异构体的是( )
| A. |  | B. |  | C. | HC≡C-CH2Cl | D. | (CH3CH2)3COH |
3.除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是( )
| 项目 | 物质 | 杂质(少量) | 试剂 | 操作方法 |
| A | CO2 | SO2 | 饱和NaHCO3溶液 | 洗气 |
| B | 硝酸 | 盐酸 | 过量的AgNO3溶液 | 过滤 |
| C | 溴苯 | 溴 | 加入CCl4 | 分液 |
| D | Na2CO3 | Na2SO4 | 加入适量BaCl2溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
13.如图是常见四种有机物的比例模型示意图.下列说法不正确的是( )
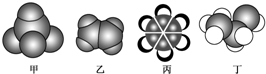

| A. | 甲不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与溴的四氯化碳溶液发生加成反应而使溴的四氯化碳溶液褪色 | |
| C. | 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
17.下列物质与溴水混合后振荡,静置.溶液分层且上层呈红棕色的是( )
| A. | 苯 | B. | 酒精 | C. | 四氯化碳 | D. | 碘化钾溶液 |
7.下列有关Na2CO3和NaHCO3性质的说法中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 相同温度下,在水中Na2CO3的溶解度小于NaHCO3 | |
| C. | Na2CO3 和NaHCO3均可与澄清石灰水反应 | |
| D. | 106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 |
