题目内容
室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )

A.x数值为2×10-5 B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d 点变到a点 D.b点与d对应的的溶度积相等
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO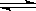 2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /×10-3 mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO) / ×10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |


 下列说法中,不正确的是
下列说法中,不正确的是
 A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
 B.在该温度下,反应的平衡常数K=5
B.在该温度下,反应的平衡常数K=5
 C.若将容积缩小为原来的一半,NO转化率大于90%
C.若将容积缩小为原来的一半,NO转化率大于90%
 D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:__________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__________mol•L-1
(2)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是__________.
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]
D.向水中加入NH4Cl固体
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__________(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(4)下列说法不正确的是(填序号〕____________。
A.某温度下纯水中的c(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下pH均为8 的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
(5)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________.