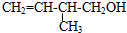题目内容
17.已知黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,但可溶于稀硝酸.黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g.
③量取25.00mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成.
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80g.
(1)检验①的溶液中是否存在K+的操作是用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+.
(2)黄钾铵铁矾的化学式为什么?(写出计算过程)
分析 (1)根据实验室检验钾离子的实验操作完成,金属钾离子用焰色反应进行检验;
(2)②9.32g为不溶于盐酸的硫酸钡沉淀;
③标准状况下气体224mL气体为氨气,红褐色沉淀为氢氧化铁;
④得到的固体是氧化铁;
根据以上分析数据及电荷守恒,计算出黄钾铵铁矾各种成分的物质的量之比,就是黄钾铵铁矾的化学式.
解答 解:(1)通过焰色反应检验钾离子存在情况,方法为:用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+,
故答案为:用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+;
(2)②的沉淀为硫酸钡,硫酸钡的物质的量就等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=$\frac{9.32g}{233g/mol}$=0.04 mol
③所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)=$\frac{0.224L}{22.4L/mol}$=0.01 mol
④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×$\frac{4.8g}{160g/mol}$=0.06 mol
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)=0.01 mol,
根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol
n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12
黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12,
答:黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12.
点评 本题考查了制取黄钾铵铁矾,涉及的内容不多,但是计算量稍大,注意合理分析、理解题中信息及电荷守恒的应用,题目难度中等.

| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3COO-、Fe2+ | |
| B. | 水电离的OH-浓度为10-12mol/L的溶液中:Mg2+、NH4+、AlO2-、SO32- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(K2C2O4)=0.5mol/L溶液中:Na+、K+、MnO4-、Cl- |