题目内容
 由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象.
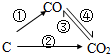
由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象.(1)如图为碳及其氧化物的变化关系图,若①变化是置换反应则其化学方程式可为(写一个即可)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正) |

CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式
(4)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(4)转化中得到的合成气制备甲醇.反应为CO(g)+2H2(g)?CH3OH(g) 某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
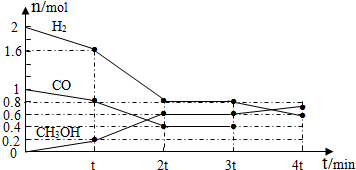
据上图计算,从反应开始到t min时,用H2浓度变化表示的平均反应速率v(H2)=
②t mi至2t min时速率变化的原因可能是
③3t min时对反应体系采取了一个措施,至4t min时CO的物质的量为0.5mol,请完成上图CO的曲线.
(5)某同学按下图所示的装置用甲醇燃料电池(装置I)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL 0.4mol/L硫酸铜溶、液.当装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8).
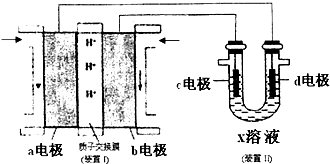
①装置I中、H+向
②铜的相对原子质量的表达式为
考点:化学平衡的计算,化学方程式的书写,有关反应热的计算,电解原理
专题:
分析:(1)碳和二氧化碳反应生成一氧化碳;碳与水蒸气和碳与二氧化碳反应是吸热反应;
(2)再利用II中的Q来判断反应进行的方向,从而得出正逆反应速率的关系;
(3)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,依据热化学方程式的书写方法写出,标注物质聚集状态和对应焓变;
(4)①根据v=
进行计算;
②反应速率加快,而且在t的时刻,达平衡状态进行分析求解;
③平衡正向移动,是增加CO的量导致平衡正向移动;
(5)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极;
②根据阳极产生气体的体积,求出整个过程中转移电子的物质的量,然后铜的相对原子质量.
(2)再利用II中的Q来判断反应进行的方向,从而得出正逆反应速率的关系;
(3)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,依据热化学方程式的书写方法写出,标注物质聚集状态和对应焓变;
(4)①根据v=
| △c |
| △t |
②反应速率加快,而且在t的时刻,达平衡状态进行分析求解;
③平衡正向移动,是增加CO的量导致平衡正向移动;
(5)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极;
②根据阳极产生气体的体积,求出整个过程中转移电子的物质的量,然后铜的相对原子质量.
解答:
解:(1))碳和二氧化碳反应生成一氧化碳,方程式为:C+H2
H2+CO;碳与水蒸气和碳与二氧化碳反应是吸热反应,所以①③的变化过程是吸热反应,故答案为:C+H2
H2+CO;①③;
(2)由Ⅰ可求K=
=104,
由Ⅱ可求Q=
=
×104<K,
故平衡右移,v(正)>v(逆),故答案为:>;
(3)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,1gCH4燃烧生成一氧化碳和氢气放热2.21kJ,16g甲烷燃烧生成二氧化碳和液态水放出热量16×2.21kJ=35.36KJ,16g甲烷为1mol,则甲烷不完全燃烧的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ?mol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ?mol-1;
(4)①根据v=
=
=
mol/(L?min),故答案为:
mol/(L?min);
②反应速率加快,而且在t的时刻,达平衡状态,可能是反应受热或使用了催化剂,故答案为:反应受热或使用了催化剂;
③平衡正向移动,是增加CO的量导致平衡正向移动,所以图象为: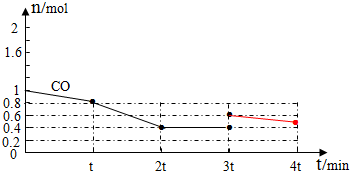 ,故答案为:
,故答案为: ;
;
(5)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极,所以与d极相连的a极为正极,原电池中阳离子向正极移动,b电极为负极是燃料发生氧化反应,反应方程式为:CH3OH-6eˉ+H2O=CO2+6H+,故答案为:a、CH3OH-6eˉ+H2O=CO2+6H+;
②整个过程中转移电子的物质的量为:
×4,所以生成铜的物质的量为:
,所以铜的相对原子质量的表达式为
,故答案为:
.
| ||
| ||
(2)由Ⅰ可求K=
| 4.0×10-2 | ||
2.0×10-4×
|
由Ⅱ可求Q=
| 5.0×10-2 | ||
3.0×10-4×
|
| 5 |
| 6 |
故平衡右移,v(正)>v(逆),故答案为:>;
(3)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,1gCH4燃烧生成一氧化碳和氢气放热2.21kJ,16g甲烷燃烧生成二氧化碳和液态水放出热量16×2.21kJ=35.36KJ,16g甲烷为1mol,则甲烷不完全燃烧的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ?mol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ?mol-1;
(4)①根据v=
| △c |
| △t |
| ||
| t |
| 1 |
| 5t |
| 1 |
| 5t |
②反应速率加快,而且在t的时刻,达平衡状态,可能是反应受热或使用了催化剂,故答案为:反应受热或使用了催化剂;
③平衡正向移动,是增加CO的量导致平衡正向移动,所以图象为:
 ,故答案为:
,故答案为: ;
;(5)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极,所以与d极相连的a极为正极,原电池中阳离子向正极移动,b电极为负极是燃料发生氧化反应,反应方程式为:CH3OH-6eˉ+H2O=CO2+6H+,故答案为:a、CH3OH-6eˉ+H2O=CO2+6H+;
②整个过程中转移电子的物质的量为:
| 10-3×V1 |
| 22.4 |
| V1 |
| 11200 |
| 11200m |
| V1 |
| 11200m |
| V1 |
点评:本题考查溶度积、化学反应热、平衡的移动和电化学的相关知识,综合性强,比较有难度.

练习册系列答案
相关题目
绚丽的焰火将上海世博会开幕式推向了高潮.焰火与“焰色反应”知识有关.下列有关“焰色反应”的说法中正确的是( )
| A、做焰色反应实验时,用H2SO4清洗铂丝 |
| B、焰色反应是单质特有的性质 |
| C、焰色反应是化学变化 |
| D、透过蓝色钴玻璃观察,KCl与K2SO4灼烧时火焰颜色均为紫色 |
下列叙述正确的是( )
| A、同温同压下,相同体积的物质,它们的物质的量必相等 |
| B、任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等 |
| C、1L一氧化碳所体一定比1L氧气质量小 |
| D、等体积、等物质的量浓度的盐酸和醋酸(CH3COOH)中所含的H+数一定相等 |
由
H、
H、
O三种原子组成水一共有( )
1 1 |
2 1 |
16 8 |
| A、1种 | B、2种 | C、3种 | D、4种 |
醋酸的下列性质中,可以证明它是弱电解质的是( )
| A、溶液的导电能力比盐酸弱 |
| B、1mol/L醋酸溶液中c(H+)=0.01 mol?L-1 |
| C、醋酸能与水任何比例互溶 |
| D、与等物质的量的NaOH恰好完全反应 |
将2mol PCl3和1mol Cl2充人一容积不变的密闭容器中,在一定条件下反应:PCl3(g)+Cl2(g)?PCl 5(g)达平衡时,PC15为0.4mol.此时若移走1molPCl3和0.5molCl2,在相同温度下达平衡时PCl5的物质的量是( )
| A、0.4 mol |
| B、小于0.2 mol |
| C、0.2 mol |
| D、大于0.2 m01而小于0.4 mol |
