题目内容
12.除去括号中杂质,写出所加试剂与反应的离子方程式.①Na2SO4溶液(Na2CO3):所加试剂H2SO4(填化学式,下同),离子方程式2H++CO32-=CO2↑+H2O.
②KCl溶液(K2SO4):所加试剂BaCl2,离子方程式Ba2++SO42-=BaSO4↓.
③FeSO4溶液(CuSO4):所加试剂Fe,离子方程式Fe+Cu2+=Fe2++Cu.
分析 ①硫酸与碳酸钠反应生成硫酸钠和水、二氧化碳;
②硫酸钾与氯化钡反应生成氯化钾与硫酸钡;
③铁与硫酸铜反应生成硫酸亚铁与铜.
解答 解:①硫酸与碳酸钠反应生成硫酸钠和水、二氧化碳,加入硫酸可以除去碳酸钠,离子方程式:2H++CO32-=CO2↑+H2O;
故答案为:?H2SO4;2H++CO32-=CO2↑+H2O;
②硫酸钾与氯化钡反应生成氯化钾与硫酸钡,加入氯化钡可以除去硫酸钾,离子方程式:Ba2++SO42-=BaSO4↓;
故答案为:BaCl2;Ba2++SO42-=BaSO4↓;
③铁与硫酸铜反应生成硫酸亚铁与铜,加入铁可以除去硫酸铜,离子方程式:Fe+Cu2+=Fe2++Cu
故答案为:Fe;Fe+Cu2+=Fe2++Cu.
点评 本题考查了离子反应方程式书写及除杂,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列叙述正确的是( )
| A. | 标准状况下,1mol 任何物质所占的体积都约为22.4L | |
| B. | 1mol 氖气和1mol氧气体积相同 | |
| C. | 标准状况下,6.02×1023个分子所占的体积约为22.4L | |
| D. | 标准状况下,1mol氧气和氮气的混合气体(任意比)的体积约为22.4L |
3.化学在生产和日常生活中有着重要的应用.下列说法正确的是( )
| A. | 人类利用的能源都是通过化学反应获得的 | |
| B. | 电解熔融氯化钠,可制得金属钠 | |
| C. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| D. | 在铁水闸上外接电源的正极,可保护铁水闸 |
7.下列说法中不正确的是( )
| A. | 三氧化二铝属于两性氧化物 | |
| B. | 用热的纯碱溶液洗涤沾有油污的物品时,发生的主要是化学变化 | |
| C. | 液氨、液氯、液态氯化氢都是非电解质 | |
| D. | 光导纤维的基本原料为SiO2 |


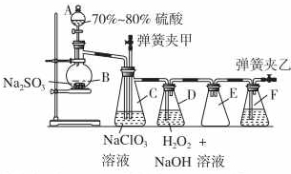 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.