题目内容
10.下列说法正确的是( )| A. | 把100mL3mol•L-1的H2SO4跟100mL水混合,硫酸的物质的量浓度变为1.5 mol•L-1 | |
| B. | 把200mL3mol•L-1的BaCl2溶液跟100mL3mol•L-1的KCl溶液混合后,溶液中的c(Cl- )仍然是3mol•L-1 | |
| C. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
分析 A.等体积混合,总体积小于200mL;
B.可计算总的物质的量,结合总体积约为300mL计算;
C.和水混合前后,NaCl的质量不变;
D.1 L 水中溶解 0.2 mol 硝酸钾,体积大于1L.
解答 解:A.将硫酸和水等体积混合,总体积小于200mL,则把100mL3mol•L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度大于1.5mol•L-1,故A错误;
B.把200mL3mol•L-1的BaCl2溶液跟100mL3mol•L-1的KCl溶液混合,n(Cl-)=0.2L×2×3mol/L+0.1L×3mol/L=1.5mol/L,体积为300mL,则c(Cl- )=5mol•L-1,故B错误;
C.稀释中溶质的氯化钠质量不变为20g,溶液质量变为原来2倍,为200g,所以混合后,NaCl溶液的质量分数是10%,故C正确;
D.1 L 水中溶解 0.2 mol 硝酸钾,体积大于1L,则浓度小于0.2mol/L,故D错误.
故选C.
点评 本题考查质量分数和浓度的计算,为高频考点,侧重考查学生的分析、计算能力的考查,把握公式为解答的关键,注意气体体积的影响因素及溶液组成的表示方法,题目难度不大.

练习册系列答案
相关题目
1. 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )| A. | 该物质可以视为酚类 | |
| B. | 在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体 | |
| C. | 能使溴的四氯化碳溶液褪色 | |
| D. | 该物质分子中的所有碳原子均共面 |
15. 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
19.下列叙述正确的是( )
| A. | 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应在任何温度下均可自发进行 | |
| D. | 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol•L-1 AgNO3溶液,先生成Ag2CrO4沉淀 |
20.下列说法正确的是( )
| A. | 在实验室中,从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色,水层变为棕黄色,说明Fe2+的还原性强于Br- | |
| D. | 室温下,向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,以除去苯中少量的苯酚 |
 在实验室中用浓盐酸与MnO2共热制取Cl2.
在实验室中用浓盐酸与MnO2共热制取Cl2.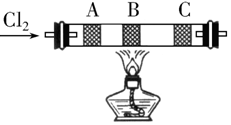 在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.
在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.