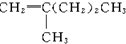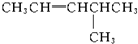题目内容
9.图中A、B、C、D各图为元素周期表的一部分,表中数字为原子序数,其中x为37的是( )| A. | 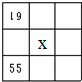 | B. |  | C. | 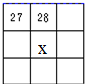 | D. | 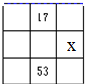 |
分析 x为37的元素核外各层电子数分别为2、8、18、8、1,位于周期表第四周期ⅠA族,结合各元素位置关系进行判断.
解答 解:x为37的元素核外各层电子数分别为2、8、18、8、1,位于周期表第四周期ⅠA族,
A.19号元素为K,与X位于相同主族,故A错误;
B.X为K,20号元素为Ca,56号元素为Ba,位置正确,故B正确;
C.28号元素为Ni,为Ⅷ族元素,故C错误;
D.17号元素为Cl,X为Rb,位置错误,故D错误.
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子序数判断元素及其在周期表位置为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.新型合成弹性材料的结构简式如下: 合成此种弹性材料的单体有( )
合成此种弹性材料的单体有( )
 合成此种弹性材料的单体有( )
合成此种弹性材料的单体有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
4.下列有关说法中正确的是( )
| A. | 0.1 mol/L Na2SO3溶液中c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 0.1 mol•L-1 NaHCO3溶液中;c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 对滴有酚酞的CH3COONa溶液进行加热,溶液颜色会加深 | |
| D. | 在pH=5.6的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) |
14.某有机物(分子式为C7Hx)完全燃烧时生成等物质的量的CO2与H2O,且能使溴的CCl4溶液褪色,若其结构中只含有两个-CH3,则该物质的结构(不考虑立体异构)最多有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 11种 |
1.下列是A、B、C、D、E五种短周期元素的某些性质:
(1)A原子的核外电子排布的轨道表示式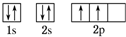 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
18.从下列材料中选择几种组成原电池,下列组合合理的是( )
①番茄②碳棒③导线④镁棒⑤铜棒⑥稀硫酸⑦烧杯.
①番茄②碳棒③导线④镁棒⑤铜棒⑥稀硫酸⑦烧杯.
| A. | ①②③ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ⑤⑥⑦ |