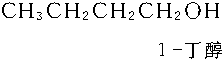题目内容
2.某共价化合物含碳、氢、氮三种元素,已知其分子内的4个氮原子排列成内空的四面体结构(如白磷结构),且每两个氮原子之间都有一个碳原子,且无C-C、C=C或-C≡C-,则该共价化合物的分子式是( )| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
分析 根据成键理论:碳周围4个键,氢周围1个键,氮周围三个键均是饱和的,据此来确定有机物的分子式.
解答 解:正四面体有6条边,所以有6个C原子,因为N原子构成正四面体的四个顶点,用完了三个共价键,所以不能再接H原子,每个C还有两个共价键可以和H原子结合,共要结合12个氢原子,即化合物的化学式是C6H12N4,故选A.
点评 本题主要考查学生有机物分子式的确定知识,注意原子的成键数目是解题的关键,难度不大.

练习册系列答案
相关题目
13.某烃的一个分子中所含电子总数比原子个数多30个,既能发生取代反应,又能发生加成反应,此烃是下列中的( )
| A. | 1-丁烯 | B. | 二甲苯 | C. | 苯 | D. | 环己烷 |
10.下列反应中有机物被还原的是( )
①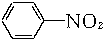 +3Fe+6HCl→
+3Fe+6HCl→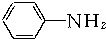 +3FeCl3+2H2O
+3FeCl3+2H2O
② +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$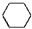
③2CH2═CH2+O2→2CH3CHO
④CH3CH2Cl+H2O$→_{△}^{NaOH}$ CH3CH2OH+HCl.
①
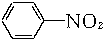 +3Fe+6HCl→
+3Fe+6HCl→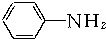 +3FeCl3+2H2O
+3FeCl3+2H2O②
 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$
③2CH2═CH2+O2→2CH3CHO
④CH3CH2Cl+H2O$→_{△}^{NaOH}$ CH3CH2OH+HCl.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
14. 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如下表:
①某温度下,将2molCO(g)和6molH2(g)充入2L密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol/L,则CO(g)的转化率为50%,此时的温度为300℃.
②在恒容条件下,要提高CO(g)的转化率,可以采取的措施有DE(填字母序号).
A、升高温度 B、加入催化剂 C、增加CO(g)的浓度
D、充入H2(g)加压E、分离出甲醇 F、充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
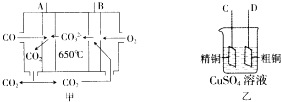
(3)如图甲是--碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请回答下列问题:
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2.
②要进行粗铜的精炼实验时,则B极应与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下) CO时,粗铜电极理论上减少铜的质量小于(填“大于”、“等于”或“小于”)6.4g.
 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如下表:
| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
②在恒容条件下,要提高CO(g)的转化率,可以采取的措施有DE(填字母序号).
A、升高温度 B、加入催化剂 C、增加CO(g)的浓度
D、充入H2(g)加压E、分离出甲醇 F、充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
(3)如图甲是--碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请回答下列问题:
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2.
②要进行粗铜的精炼实验时,则B极应与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下) CO时,粗铜电极理论上减少铜的质量小于(填“大于”、“等于”或“小于”)6.4g.
11.工业上以锂辉石(Li2O-Al2O3-4SiO2,含少量Ca.Mg元素)为原料生产碳酸锂,其部分工艺流程如下:
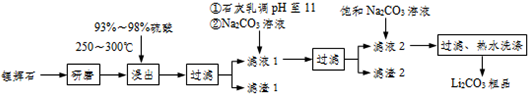
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO2和Li2OCO4的溶解度如表:
(1)过滤时需要的玻璃仪器有漏斗、玻璃棒、烧杯
(2)滤渣I中分离制取Al2O3,其流程如下图所示(括号中均表示加入过量的试剂):括号内的试剂最好选用D
A.稀盐酸 B.CO2 C.NaOH溶液 D.NHyH2O
滤渣I$→_{I}^{(H+)}$滤液$→_{II}^{()}$滤渣3$→_{Ⅲ}^{灼烧}$Al2O3
步骤Ⅱ中反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)向滤液Ⅰ中加入石灰水调pH为11的作用是让Mg2+生成Mg(OH)2沉淀,加入Na2CO3溶液的作用是让Ca2+生成 CaCO3沉淀,滤渣2的成分是Mg(OH)2和CaCO3
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(5)工业上用电解法将Li2CO3粗品制成高纯LiOH,再向溶液中加入过量NH4HCO3溶液可生成高纯Li2CO3,写出加入NH4HCO3溶液后的反应的化学方程式2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO2和Li2OCO4的溶解度如表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(2)滤渣I中分离制取Al2O3,其流程如下图所示(括号中均表示加入过量的试剂):括号内的试剂最好选用D
A.稀盐酸 B.CO2 C.NaOH溶液 D.NHyH2O
滤渣I$→_{I}^{(H+)}$滤液$→_{II}^{()}$滤渣3$→_{Ⅲ}^{灼烧}$Al2O3
步骤Ⅱ中反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)向滤液Ⅰ中加入石灰水调pH为11的作用是让Mg2+生成Mg(OH)2沉淀,加入Na2CO3溶液的作用是让Ca2+生成 CaCO3沉淀,滤渣2的成分是Mg(OH)2和CaCO3
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(5)工业上用电解法将Li2CO3粗品制成高纯LiOH,再向溶液中加入过量NH4HCO3溶液可生成高纯Li2CO3,写出加入NH4HCO3溶液后的反应的化学方程式2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.
 +
+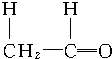 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$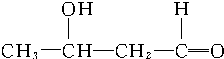
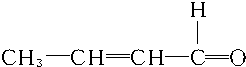 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$