题目内容
12.现有下列8种物质:①Na2CO3②NaHCO3③HCl④NH4HCO3⑤C2H5OH⑥Al⑦食盐水⑧CH3COOH(1)上述物质中属于强电解质的是①②③④(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是②④⑥(填序号)
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)HCO3-+H2O=H2CO3+OH-.
(3)④与足量的NaOH浓溶液在加热条件下反应的离子方程式为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
分析 ①Na2CO3是盐,属于强电解质,只能与盐酸反应;
②NaHCO3属于盐,是强电解质,既能与盐酸反应生成二氧化碳气体,又能与氢氧化钠反应生成碳酸钠;
③HCl属于强酸,是强电解质;
④NH4HCO3属于盐,既能与酸反应生成二氧化碳气体,又能与碱反应生成氨气;
⑤C2H5OH属于非电解质;
⑥Al既能跟NaOH溶液反应,又能跟盐酸反应;
⑦食盐水属于混合物;
⑧CH3COOH是弱酸,属于弱电解质;据此解答即可.
解答 解:(1)①Na2CO3是盐,属于强电解质,只能与盐酸反应;
②NaHCO3属于盐,是强电解质,既能与盐酸反应生成二氧化碳气体,又能与氢氧化钠反应生成碳酸钠;
③HCl属于强酸,是强电解质;
④NH4HCO3属于盐,既能与酸反应生成二氧化碳气体,又能与碱反应生成氨气;
⑤C2H5OH属于非电解质;
⑥Al既能跟NaOH溶液反应,又能跟盐酸反应;
⑦食盐水属于混合物;
⑧CH3COOH是弱酸,属于弱电解质,故答案为:①②③④;②④⑥;
(2)碳酸氢钠属于强碱弱酸盐,水解呈碱性,离子反应方程式为:HCO3-+H2O=H2CO3+OH-,故答案为:HCO3-+H2O=H2CO3+OH-;
(3)碳酸氢铵与氢氧化钠反应生成氨气和碳酸根,离子反应方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O,故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
点评 本题主要考查的是电解质与强电解质的概念、Al的两性以及两性化合物,难度不大,注意离子反应方程式的正确书写是关键.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
2.下列说法中,正确的是( )
| A. | 标准状况下,1mol任何物质的体积都约为22.4L | |
| B. | 1mol任何气体所含分子数都相同,体积也都约为22.4L | |
| C. | 同温同压下,相同体积的任何气体单质所含原子数目相同 | |
| D. | 常温常压下0.3mol H2、0.7mol N2组成的混合气体共含有NA个分子 |
3.MgCl2•6H2O在高温灼烧时,其分解产物为( )
| A. | MgCl2和H2O | B. | Mg(OH)2、HCl和H2O | C. | Mg、Cl2和H2O | D. | MgO、HCl和H2O |
20.下列叙述,说法合理的是( )
| A. | 任何物质燃烧都必须有氧气参加 | |
| B. | 氢气在氯气中燃烧发出淡蓝色火焰,并在空气中产生大量白雾 | |
| C. | 饱和氯水在光照下有气泡产生,该气体为氯气 | |
| D. | 长久放置的氯水将失去漂白性 |
7.下列与氯气的氧化性无关的是( )
| A. | 氯气被碱液吸收 | B. | 金属钠在氯气中燃烧 | ||
| C. | 氯气变为液氯 | D. | 氯气溶于水 |
17.下列物质或微粒中,按只有还原性,只有氧化性,既有氧化性又有还原性的顺序排列的一组是( )
| A. | Na、Cl2、Br2 | B. | H2、N2O4、Cl2 | C. | I-、F2、H2O | D. | SO2、H+、HCl |
1.下列叙述正确的是( )
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 离子晶体中只含有离子键 | |
| D. | 分子晶体中只存在分子间作用力,不含化学键 |
2.某共价化合物含碳、氢、氮三种元素,已知其分子内的4个氮原子排列成内空的四面体结构(如白磷结构),且每两个氮原子之间都有一个碳原子,且无C-C、C=C或-C≡C-,则该共价化合物的分子式是( )
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
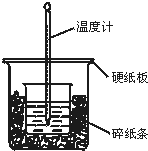 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: