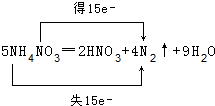
题目内容
13.某学生配制了100mL 1mol/L的硫酸溶液,在配制过程中,下列操作可能导致溶液浓度偏低的是( )①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切.
| A. | ②③④ | B. | ③④ | C. | ①②③ | D. | ①②③④ |
分析 分析不当操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:①量筒用蒸馏水洗净后立即用来量取浓硫酸,导致量取的硫酸的物质的量偏小,溶液浓度偏低,故选;
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯,导致溶质的物质的量偏小,溶液浓度偏小,故选;
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏小,故选;
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切,导致溶质的物质的量偏小,溶液浓度偏小,故选;
故选:D.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度不大,可以根据操作对c=$\frac{n}{V}$的影响进行判断.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
4.下列说法错误的是( )
| A. | 由单质A转化为单质B,△H=+119kJ/mol,可知单质A比单质B稳定 | |
| B. | 灼热的碳与CO2反应既是氧化还原反应,又是吸热反应 | |
| C. | 决定化学反应速率的根本因素是参加反应的各物质的结构和性质 | |
| D. | 对于一个可逆反应(△H<0)达到平衡后,升高温度可以使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
1.下列关于摩尔质量的说法正确的是( )
| A. | HNO3的摩尔质量是63g | |
| B. | 物质的摩尔质量越大,物质的质量越大 | |
| C. | 摩尔质量就等于该物质的相对分子质量 | |
| D. | 醋酸的摩尔质量在数值上与NA个醋酸分子的质量相等 |
8.在一定条件下的密闭容器中发生反应:N2O4(g)?2NO2(g),经1min后反应达到平衡,c(N2O4)从0.100mol•L-1降为0.040mol•L-1,下列有关说法中,不正确的是( )
| A. | 1min内的平均反应速率v(N2O4)为0.060mol•L-1•min-1 | |
| B. | 若容器的体积为1L,则反应经0.5min后容器内n(NO2)为0.060mol | |
| C. | 反应达到平衡前,2v(N2O4)=v(NO2) | |
| D. | 反应达到平衡时,2v(N2O4)=v(NO2) |
18.质量为4.6g的金属钠(含一种杂质)放入足量的盐酸中,可以收集到0.18g的气体,则钠中不可能含有的杂质是( )
| A. | Al | B. | K | C. | Cu | D. | Mg |
6.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
7.下列操作或仪器选用不正确的是( )
| A. |  石油蒸馏 | B. |  检验Fe3+ | C. |  制备氨气 | D. |  中和滴定 |