题目内容
6g Mg、Cu合金与一定量的硝酸恰好完全反应,收集到标准状况下VL NO和NO2的混合气体.向反应后的溶液中加入足量NaOH溶液,得到沉淀12.12g.则V的值可能是( )
| A、2.688 | B、4.48 | C、8.064 | D、8.96 |
分析:得到的沉淀是Cu(OH)2 和Mg(OH)2的混合物,质量增加量其实就是结合的OH-的质量,计算氢氧根的物质的量,根据电荷守恒可知,Cu、Mg共失去电子物质的量等于氢氧根的物质的量,采用极值法计算:假设得到的气体全是NO,假设得到的气体全是NO2,根据电子转移守恒计算气体物质的量,再计算生成气体体积,混合气体体积在二者之间.
解答:解:得到的沉淀是Cu(OH)2 和Mg(OH)2的混合物,质量增加量其实就是结合的OH-的质量,
所以m(OH-)=12.12g-6g=6.12g,因此 n(OH-)=
=0.36 mol,
根据电荷守恒可知,金属提供电子物质的量等于氢氧根的物质的量,即金属提供电子为0.36mol,
假设得到的气体全是NO,由电子转移守恒可知,n(NO)=
=0.12mol,所以NO体积是:0.12 mol×22.4 L/mol=2.688 L;
假设得到的气体全是NO2,由电子转移守恒可知,n(NO2)=
=0.36mol,所以NO2体积是:0.36 mol×22.4 L/mol=8.064 L;
因为得到是混合气体,因此体积在二者之间,选项B符合.
故选:B.
所以m(OH-)=12.12g-6g=6.12g,因此 n(OH-)=
| 6.12g |
| 17g/mol |
根据电荷守恒可知,金属提供电子物质的量等于氢氧根的物质的量,即金属提供电子为0.36mol,
假设得到的气体全是NO,由电子转移守恒可知,n(NO)=
| 0.36mol |
| 5-2 |
假设得到的气体全是NO2,由电子转移守恒可知,n(NO2)=
| 0.36mol |
| 5-4 |
因为得到是混合气体,因此体积在二者之间,选项B符合.
故选:B.
点评:本题考查了混合物计算,难度中等,若根据方程式计算便误入歧途,利用电子守恒、质量守恒计算就简捷省时,平时要善于总结、积累.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
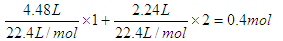 ,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。