题目内容
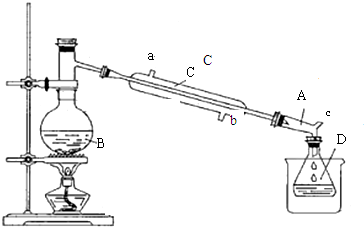
3.溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如图:反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:
实验中可能用到的数据如下表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)
分析 (1)在蒸馏烧瓶中加入碎瓷片,可以防止瀑沸;
(2)根据仪器B的构造进行解答;
(3)冷凝管的通水方向为逆向通水,据此进行解答;
(4)根据溴乙烷沸点较低,难溶于水进行分析;
(5)乙醇沸点较低,生成的溴乙烷中会混有杂质乙醇,加水的目的是除去杂质乙醇;
(6)根据乙醇的体积计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率.
解答 解:(1)在蒸馏烧瓶中加入碎瓷片,可以防止瀑沸,故答案为:防止瀑沸;
(2)根据图示装置可知,仪器B为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(3)为了提高冷凝效果,冷凝管中通水方向采用逆向通水的方法,即从b进水,从a出水,故答案为:b;
(4)根据表中数据可知,溴乙烷的沸点为38.4℃,且难溶于水,所以使用冰水冷却溴乙烷,故答案为:冷却溴乙烷;
(5)制取的溴乙烷中会混有乙醇,根据溴乙烷难溶于水,而乙醇易溶于水,可以加水振荡后除去溴乙烷中溶解的乙醇,故答案为:除去溶解在溴乙烷中乙醇;
(6)50mL乙醇的质量为:0.79g/mL×50mL=39.5g,乙醇的物质的量为:$\frac{39.5g}{46g/mol}$≈0.86mol,根据反应原理可知,理论上生成溴乙烷的物质的量为0.86mol;
52mL溴乙烷的物质的量为:$\frac{1.42g/mL×52mL}{109g/mol}$≈0.68mol,溴乙烷的产率为:$\frac{0.68mol}{0.86mol}$×100%≈79%,
故答案为:79%.
点评 本题考查了溴乙烷的制取方法,题目难度中等,涉及了仪器构造及使用方法、物质的提纯与除杂、化学计算等知识考查,注意掌握溴乙烷的制取原理,(6)为易错点,注意溴乙烷产率的计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列有关尽应中不属于离子反应的是( )
| A. | Na2CO3溶液与澄清石灰水的反应 | |
| B. | 氢氧化铜与稀硫酸的反应 | |
| C. | 锌与氯化铜溶液的反应 | |
| D. | 二氧化碳与生石灰作用生成碳酸钙的反应 |
15.已知某温度时:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,在相同下条件下,向容器中通入1molN2和3molH2,达到平衡时放出热量为69kJ.则N2的转化率为( )
| A. | 25% | B. | 50% | C. | 75% | D. | 无法计算 |
12.下列实验操作正确且能达到实验目的都是( )
| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
13.下列溶液因水解显碱性的是( )
| A. | 碳酸钠 | B. | 硝酸钠 | C. | 石灰水 | D. | 氯化铜 |

 ,E的电子式
,E的电子式 ,y的结构式H-Cl;
,y的结构式H-Cl; ;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+
;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+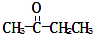 )、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.
)、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.