题目内容
8.已知A(g)+xB(g)?2C(g),一定温度下,某密闭容器中充入等物质的气体A和B发生上述反应,达到平衡后,只改变反应的一个条件,测得容器内有关物质的浓度、反应速率随时间变化的关系如图所示.
请回答下列问题:
(1)x=1.0-20min内用B的浓度变化表示的平均反应速率为0.05mol/(L•min),在左图中补充缺失的物质在0-30min内浓度变化曲线.一定条件下,当v正(B):v逆(C)=1:2时的状态即为化学平衡状态.
(2)20min~30min内该反应的化学平衡常数为4,若25min,35min,55min时时的化学平衡常数分别为K1,K2,K3,则三者大小关系为:K1=K2<K3
(3)已知A(g)+xB(g)?2C(g)△H=-QkJ/mol,该反应生成2molC时放出(填“放出”或“吸收”)等于(填“大于”“小于”或“等于”)QkJ的热量.
分析 (1)由图象可知,30min时瞬间浓度增大相同的倍数,正、逆反应速率增大相同倍数,反应仍处于平衡状态,故不能是温度变化,而是压缩体积增大压强,平衡不移动,则1+x=2,故x=1;
由图可知20min内A、B浓度变化量均为1mol/L,根据v=$\frac{△c}{△t}$计算v(B);
A、B起始浓度相同,反应按1:1反应,故A、B浓度变化曲线重合;
可能反应到达平衡时,不同物质表示的正逆速率之比等于化学计量数之比;
(2)20min~30min内平衡时A、B浓度均为1mol/L,C的浓度为2mol/L,代入平衡常数K=$\frac{{c}^{2}(C)}{c(A)×c(B)}$计算;
25min、35min温度相同,平衡常数相同,40min时反应速率减低,而C的浓度增大、A或B的浓度减小,平衡向正反应进行,而反应前后气体体积不变,应是降低温度,平衡常数增大;
(3)A(g)+xB(g)?2C(g)△H=-QkJ/mol表示该反应生成2molC时放出QkJ的热量.
解答 解:(1)由图象可知,30min时瞬间浓度增大相同的倍数,正、逆反应速率增大相同倍数,反应仍处于平衡状态,故不能是温度变化,而是压缩体积增大压强,平衡不移动,则1+x=2,故x=1;
由图可知20min内A、B浓度变化量均为1mol/L,则v(B)=$\frac{1mol/L}{20min}$=0.05mol/(L•min);
A、B起始浓度相同,反应按1:1反应,故A、B浓度变化曲线重合, ;
;
可能反应到达平衡时,不同物质表示的正逆速率之比等于化学计量数之比,即v正(B):v逆(C)=1:2,
故答案为:1;0.05mol/(L•min); ;1:2;
;1:2;
(2)20min~30min内平衡时A、B浓度均为1mol/L,C的浓度为2mol/L,平衡常数K=$\frac{{c}^{2}(C)}{c(A)×c(B)}$=$\frac{{2}^{2}}{1×1}$=4,
20~30 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,故K2=K1,40min时反应速率减低,而C的浓度增大、A或B的浓度减小,平衡向正反应进行,而反应前后气体体积不变,应是降低温度,平衡正向进行,55min时处于平衡状态,平衡常数K3增大,所以K1=K2<K3;
故答案为:4;K1=K2<K3;
(3)A(g)+xB(g)?2C(g)△H=-QkJ/mol表示该反应生成2molC时放出QkJ的热量,故答案为:放出;等于.
点评 本题考查化学平衡图象问题、化学平衡常数、反应速率计算、热化学方程式等,题目难度中等,根据图象浓度的变化以及反应速率的变化判断x=1是关键,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | V1>V2>V3 | B. | V1>V3>V2 | C. | V3>V2>V1 | D. | V3>V1>V2 |
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:
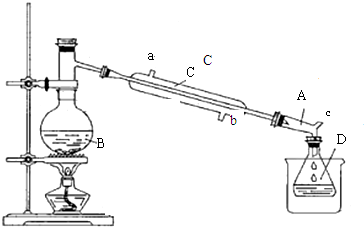
实验中可能用到的数据如下表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
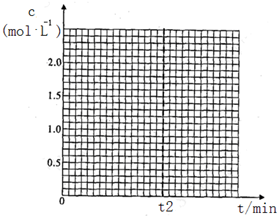
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
| A. | Na3N与水的反应是氧化还原反应 | |
| B. | Na3N 是共价化合物 | |
| C. | Na3N中4个离子均满足最外层8电子稳定结构 | |
| D. | Na3N中钠离子半径大于氮离子半径 |
