题目内容
下列有关热化学方程式的叙述正确的是( )
| A、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则相同条件下金刚石比石墨稳定 |
| C、在稀溶液中H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量等于57.3 kJ |
| D、己知2H2(g)+O2(g)=2H2O(l)△H1;2H2(g)+O2(g)=2H2O(g)△H2; 则△H1<△H2 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:A、根据热化学方程式中系数和焓变的关系来回答判断;
B、物质具有的能量越低越稳定;
C、浓硫酸的稀释过程会放出热量;
D、液态水变为气态水是一个吸热过程.
B、物质具有的能量越低越稳定;
C、浓硫酸的稀释过程会放出热量;
D、液态水变为气态水是一个吸热过程.
解答:
解:A、在101kPa时,2gH2即1mol氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,故A错误;
B、已知C(石墨,s)=C(金刚石,s);△H>0,则石墨能量低于金刚石,所以石墨稳定,故B错误;
C、浓硫酸的稀释过程会放出热量,将含0.5 mol H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ,故C错误;
D、液态水变为气态水是一个吸热过程,氢气燃烧生成气态水放热少,焓变大,即2H2(g)+O2(g)=2H2O(l)△H1;2H2(g)+O2(g)=2H2O(g)△H2,则△H1<△H2,故D正确.
故选D.
| 1 |
| 2 |
B、已知C(石墨,s)=C(金刚石,s);△H>0,则石墨能量低于金刚石,所以石墨稳定,故B错误;
C、浓硫酸的稀释过程会放出热量,将含0.5 mol H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ,故C错误;
D、液态水变为气态水是一个吸热过程,氢气燃烧生成气态水放热少,焓变大,即2H2(g)+O2(g)=2H2O(l)△H1;2H2(g)+O2(g)=2H2O(g)△H2,则△H1<△H2,故D正确.
故选D.
点评:本题涉及热化学方程式中的能量变化和热化学方程式的意义以及书写知识,注意中和热的含义是关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列化学用语表达不正确的是( )
A、次氯酸的电子式: | ||||
B、质子数为6、质量数为14的原子:
| ||||
| C、CS2的结构式:S-C-S | ||||
D、氯的原子结构示意图: |
下列化学方程式,能用离子方程式SO42-+Ba2+=BaSO4↓表示的是( )
| A、稀硫酸与氢氧化钡反应 |
| B、氢氧化钡与硫酸铜反应 |
| C、硫酸氢钠与少量氢氧化钡反应 |
| D、氯化钡与硫酸镁反应 |
已知强弱顺序:还原性I->Br->Fe2+>Cl-,氧化性Cl2>Fe3+>Br2>I2,下列反应的化学方程式或叙述不成立的是( )
| A、Br2+2HI═I2+2HBr |
| B、2FeCl2+Cl2═2FeCl3 |
| C、2FeCl2+2HCl+I2═2FeCl3+2HI |
| D、Cl2通入到NaBr和NaI的混合溶液中:I-先被氧化 |
下列表达式正确的是( )
A、O2-的结构示意图: | ||
B、碳原子的L层电子轨道表示式: | ||
| C、硫离子的核外电子排布式:1s22s22p63s23p4 | ||
D、碳-12原子:
|
有关化学用语的表达正确的是( )
A、Na2O2电子式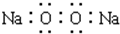 | ||
B、中子数为14的硅原子:
| ||
| C、二氧化硅的分子式SiO2 | ||
| D、乙烯的结构简式CH2CH2 |
 已知水是人体的重要组成部分,是人体中含量最多的一种物质,而“四种基本反应类型与氧化还原反应的关系”可用如图表达:
已知水是人体的重要组成部分,是人体中含量最多的一种物质,而“四种基本反应类型与氧化还原反应的关系”可用如图表达:
 0.2mol某一元醇,在密闭容器中燃烧后,其产物为CO2、CO、H2O.产物通过浓H2SO4后,浓H2SO4增重10.8g;再通过灼热的CuO充分反应后,CuO失重3.2g;最后通过碱石灰,碱石灰增重17.6g.
0.2mol某一元醇,在密闭容器中燃烧后,其产物为CO2、CO、H2O.产物通过浓H2SO4后,浓H2SO4增重10.8g;再通过灼热的CuO充分反应后,CuO失重3.2g;最后通过碱石灰,碱石灰增重17.6g.