题目内容
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:
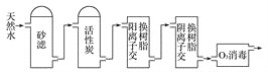
活性炭的作用是_______;O3消毒的优点是_______。
【答案】AD 加成反应 2ClO2+2CN-=2CO2+N2+2Cl- 产物为无毒无害的Cl-、CO2和N2 吸附水中的有机物(或除去水中的异味) 反应产物无毒无害
【解析】
(1)把握“原料分子中的原子全转变为所需产物”或“不产生副产物,实现零排放”,然后根据题给各选项观察反应物中所有原子是否都转化成了所需产物,据此判断反应类型的特点;
(2)先根据题意先确定反应产物:应将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,Cl元素由+4→-1价,C元素由+2→+4,N元素由-3→0价,然后再利用化合价升降法配平化学方程式;
(3)根据流程图天然水![]() 去除水中不溶性杂质
去除水中不溶性杂质![]() 通过吸附作用去除有毒、有异味的分子
通过吸附作用去除有毒、有异味的分子![]() 去除水中的阳离子
去除水中的阳离子![]() 去除水中的阴离子
去除水中的阴离子![]() 杀菌消毒来解答;
杀菌消毒来解答;
(1)A. CH2=CH2+HCl→CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,A符合同一;
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合题意;
CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合题意;
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合题意;
CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合题意;
D.CH2=CHCl+H2![]() CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,D符合同一;
CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,D符合同一;
由上述四个反应可归纳出,原子经济性高的是加成反应;
(2)ClO2具有强氧化性,可以将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子反应为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-,其优点为产物都是无毒的气体(CO2和N2),不污染环境;
(3)根据流程图天然水![]() 去除水中不溶性杂质
去除水中不溶性杂质![]() 通过吸附作用去除有毒、有异味的分子
通过吸附作用去除有毒、有异味的分子![]() 去除水中的阳离子
去除水中的阳离子![]() 去除水中的阴离子
去除水中的阴离子![]() 杀菌消毒,所以活性炭的作用为吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物是H2O,产物无毒、无害。
杀菌消毒,所以活性炭的作用为吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物是H2O,产物无毒、无害。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时![]() 增大
增大