题目内容
5. (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.(2)氨是最重要的氮肥,是产量最大的化工产品之一.其合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.,
在定容密闭容器中,使2mol N2和6mol H2混合发生反应,平衡时N2转化率为20%:
①当反应达到平衡时,N2和H2的浓度比是1:3N2和H2的转化率比是1:1,反应共放热36.96KJ.
②升高平衡体系的温度,混合气体的平均相对分子质量变小,密度不变.(填“变大”“变小”或“不变”)
③当达到平衡时,充入氩气,平衡将不(填“正向”“逆向”或“不”)移动.
④若容器绝热,加热使容器内温度迅速升至原来的2倍,平衡将逆向(填“正向”“逆向”或“不”)移动.达到新平衡后,容器内温度小于(填“大于”“小于”或“等于”)原来的2倍.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)①加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,氮气和氢气的浓度之比永始终是1:3,转化率之比1:1;根据热化学方程式根据焓变与系数成正比计算放出的热量;
②平均相对分子质量=$\frac{气体质量总和}{气体物质的量总和}$,ρ=$\frac{m}{V}$;
③定容密闭容器中,充入氩气,反应物生成物浓度不变,平衡不移动;
④运用勒夏特列原理解答.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)①加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1,
设反应共放热xKJ,则有
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
1 92.4
2×20% x
所以解得x=92.4×2×20%=36.96KJ
故答案为:1:3;1:1;36.96;
②升温,平衡逆向移动,气体物质的量增大,质量不变,气体的平均相对分子质量═$\frac{气体质量总和}{气体物质的量总和}$,所以,混合气体的平均相对分子质量减小;
因容器体积没变,气体质量不变,所以密度不变,
故答案为:变小;不变;
③定容密闭容器中,充入氩气,反应物生成物浓度不变,平衡不移动,
故答案为:不;
④升温,平衡向吸热的逆向移动,使体系温度降低,所以达到新平衡后,容器内温度小于原来的2倍,故答案为:逆向;小于.
点评 本题考查了热化学方程式的书写、反应速率与化学计量数的关系、气体的平均相对分子质量、密度、化学平衡的移动,题目难度不大.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 负极反应式:Ag+Cl-+e-═AgCl | |
| B. | Na+不断向“水”电池的正极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
| A. | HOCH2CH2COOH | B. | CH3CH(OH)COOH | C. | CH3OCH2COOH | D. | CH3CH(OH)CH2COOH |
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | 无法计算 |
| A. | HCO3- | B. | SO32- | C. | CH3COO- | D. | CO32- |
| A. | 维生素C能将+5价砷氧化成As2O3 | |
| B. | 维生素C具有还原性 | |
| C. | 青菜中含有维生素C | |
| D. | 生成砒霜的过程中砷元素发生氧化反应 |
| A. | 化合物 电解质 | B. | 化合物 胶体 | C. | 溶液 浊液 | D. | 溶液 分散系 |
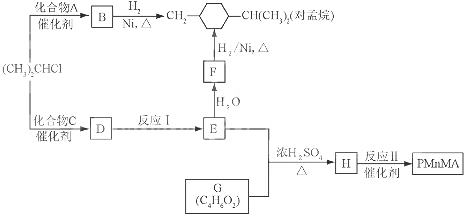

 ,
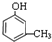
,
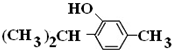 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$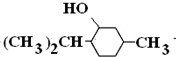
 ;.
;.