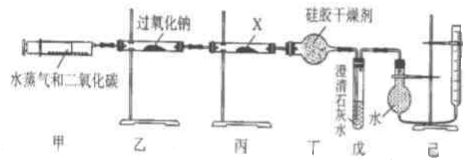
题目内容
16.下列基本实验操作中,不合理的是( )| A. | 用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子 | |
| B. | 萃取碘水中的碘,可用酒精作为萃取剂 | |
| C. | 配制一定物质的量浓度的溶液,使用容量瓶前必须检查容量瓶是否漏水 | |
| D. | 少量的钠保存在煤油中,使用后多余的钠快放回原瓶中 |
分析 A.钾离子的焰色反应呈紫色;
B.酒精与水互溶,不能用酒精作萃取剂;
C.容量瓶有瓶塞,使用前必须检查是否漏水;
D.钠化学性质活泼,需要密封保存,多余的钠若乱放,易发生火灾,应该放回原试剂瓶.
解答 解:A.检验钾离子的操作方法为:用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,故A正确;
B.酒精与水互溶,不能用酒精萃取碘水中的碘,可以用苯或四氯化碳,故B错误;
C.配制一定物质的量浓度的溶液,为了避免容量瓶漏水影响配制结果,使用容量瓶前必须检查容量瓶是否漏水,故C正确;
D.钠的化学性质活泼、密度小于煤油,所以少量的钠保存在煤油中;钠不会污染原试剂瓶中试剂,故使用后多余的钠块放回原瓶中,故D正确;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及焰色反应、容量瓶的使用、萃取、化学试剂的保存等知识,明确化学实验基本操作方法为解答关键,试题侧重基础知识的考查,培养了学生的化学实验能力.

练习册系列答案
相关题目
18.化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语中正确的是( )
| A. | K 37ClO3与浓盐酸(HCl)在加热下生成氯气的化学方程式:K 37ClO3+6HCl═K 37Cl+3Cl2↑+3H2O | |
| B. | 表示氢气燃烧热的热化学方程式:H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8 kJ/mol | |
| C. | 将1~2 mL氯化铁饱和溶液逐滴加到20 mL 沸水中所发生反应的离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe (OH)3(胶体)+3H+ | |
| D. | 在氢氧化钡溶液中滴入硫酸氢钠溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
19.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 摩尔是七个基本物理量之一 | |
| B. | 阿伏加德罗常数就是6.02×1023mol-1 | |
| C. | 1mol氢的质量是2g | |
| D. | 1个甲烷分子的质量是2.66×10-23g |
11.下列有关化学用语正确的是( )
| A. | C原子结构示意图: | |
| B. | 白磷的分子式:P | |
| C. | 含有七个中子的碳原子的核组成符号:${\;}_{12}^{6}$C | |
| D. | 次氯酸的结构式为:H-Cl-O |
1.下列反应中,水既不是氧化剂又不是还原剂,但属于氧化还原反应的是( )
| A. | 2F2+H2O═4HF+O2 | B. | Si+2NaOH+H2O═Na2SiO3+2H2↑ | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | P2O5+3H2O═2H3PO4 |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1.8 g D2O中含有的质子数和电子数均为NA | |
| D. | 0.1molNa完全被氧化生成Na2O2时,转移的电子数目为0.1NA |
6.下列所述事实与化学(或离子)方程式不相符的是( )
| A. | 能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 能说明盐酸是强酸:HCl+AgNO3=AgCl↓+HNO3 | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |