题目内容
【题目】硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
![]() 已知
已知![]() 与水反应生成乙炔。请回答下列问题:
与水反应生成乙炔。请回答下列问题:
![]() 将乙炔通入
将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀,
红棕色沉淀,![]() 基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成
基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成![]() 和Cu,但CuO在高温下会分解成
和Cu,但CuO在高温下会分解成![]() ,试从结构角度解释高温下CuO何会生成
,试从结构角度解释高温下CuO何会生成![]() :______。
:______。
![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中含有的
中含有的![]() 键数目为 ______ 。
键数目为 ______ 。
![]() 乙炔与氢氰酸反应可得丙烯腈
乙炔与氢氰酸反应可得丙烯腈![]() 丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
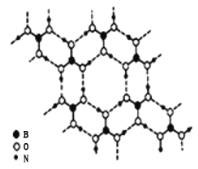
![]() 硼酸
硼酸![]() 是一种片层状结构的白色晶体,层内的
是一种片层状结构的白色晶体,层内的![]() 分子间通过氢键相连
分子间通过氢键相连![]() 如图
如图![]() 则
则![]() 的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸
的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() ,则
,则![]() 含有的化学键类型为 ______ 。
含有的化学键类型为 ______ 。
【答案】![]()
![]() 价电子排布式为
价电子排布式为![]() ,为全充满结构,更稳定
,为全充满结构,更稳定 ![]() sp、
sp、![]() N 3 共价键、配位键
N 3 共价键、配位键
【解析】
(1) ①Cu+基态核外电子排布式为![]() ;
;![]() 价电子排布式为
价电子排布式为![]() ,为全充满结构,更稳定,据此作答;②
,为全充满结构,更稳定,据此作答;②![]() 与
与![]() 互为等电子体,则
互为等电子体,则![]() 中氧原子之间形成
中氧原子之间形成![]() 叁键,叁键中有1个
叁键,叁键中有1个![]() 键、2个
键、2个![]() 键,据此作答;
键,据此作答;
③根据有机C原子的杂化规律,![]() 中,
中,![]() C、CH中碳原子含一个双键,采取
C、CH中碳原子含一个双键,采取![]() 杂化,而CN中碳原子含一个叁键,采取sp杂化;H元素非金属性最小、其第一电离能最小,同周期随原子序数增大第一电离能呈增大趋势,N元素第一电离能大于C元素,据此解答;
杂化,而CN中碳原子含一个叁键,采取sp杂化;H元素非金属性最小、其第一电离能最小,同周期随原子序数增大第一电离能呈增大趋势,N元素第一电离能大于C元素,据此解答;
(2) 由图可知,一个![]() 分子对应着6个氢键,而一个氢键对应着2个
分子对应着6个氢键,而一个氢键对应着2个![]() 分子,据此作答;
分子,据此作答;![]() 中O与H原子之间形成共价键、O与B之间形成配位键,含有的化学键类型为共价键、配位键,据此解答;
中O与H原子之间形成共价键、O与B之间形成配位键,含有的化学键类型为共价键、配位键,据此解答;
(1)①![]() 基态核外电子排布式为
基态核外电子排布式为![]() ;
;![]() 价电子排布式为
价电子排布式为![]()
![]() ;
;
故答案为:![]() ;
;![]() 价电子排布式为
价电子排布式为![]() ,为全充满结构,更稳定;
,为全充满结构,更稳定;
②CaC2中![]() 与
与![]() 互为等电子体,则
互为等电子体,则![]() 中氧原子之间形成
中氧原子之间形成![]() 叁键,叁键中有1个
叁键,叁键中有1个![]() 键、2个
键、2个![]() 键,
键,![]() 中含有的
中含有的![]() 键数目为
键数目为![]() ;
;
故答案为:![]() ;
;
③乙炔与氢氰酸反应可得丙烯腈![]() ,丙烯腈分子中碳原子没有孤对电子,
,丙烯腈分子中碳原子没有孤对电子,![]() C、CH中碳原子均形成3个
C、CH中碳原子均形成3个![]() 键,采取
键,采取![]() 杂化,而CN中碳原子形成2个
杂化,而CN中碳原子形成2个![]() 键,采取sp杂化;H元素非金属性最小、其第一电离能最小,同周期随原子序数增大第一电离能呈增大趋势,N元素第一电离能大于C元素;
键,采取sp杂化;H元素非金属性最小、其第一电离能最小,同周期随原子序数增大第一电离能呈增大趋势,N元素第一电离能大于C元素;
故答案为:sp、![]() ;N;
;N;
![]() 由图可知,一个
由图可知,一个![]() 分子对应着6个氢键,而一个氢键对应着2个
分子对应着6个氢键,而一个氢键对应着2个![]() 分子,因此含有
分子,因此含有![]() 分子的晶体中有3mol氢键,
分子的晶体中有3mol氢键,![]() 中O与H原子之间形成共价键、O与B之间形成配位键,含有的化学键类型为共价键、配位键;
中O与H原子之间形成共价键、O与B之间形成配位键,含有的化学键类型为共价键、配位键;
故答案为:3;共价键、配位键;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案