��Ŀ����
����Ŀ����1�����ݹ����ſ��Զ��л�����з��ࡢ����ͳ��ӡ�
�������л�������������___������ĸ����
a����Ȳ b���Ҵ� c������
�����ּױ��ͱ������õ��Լ���___������ĸ����
a��FeCl3��Һ b������KMnO4��Һ c����ˮ
�۳�ȥ���������е����ᣬ���õ��Լ���___������ĸ����
a��NaOH��Һ b��NaCl��Һ c������Na2CO3��Һ
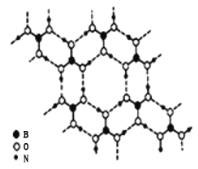
��2���������һ����Ҫ���л�����ԭ�ϡ�������Ľṹ��ʽΪ![]() ��
��
��������������___��̼ԭ�ӹ�ƽ�棬��˴Ź�����������___���塣
����������������ȡ����ʽΪC6H6O�ķ����廯����û�����Ľṹ��ʽ��___��
��������Ʊ�����������Ļ�ѧ����ʽΪ___��
��3��������III��һ�ֺϳ�ҽҩ���м��壬��ϳ�·�����£�
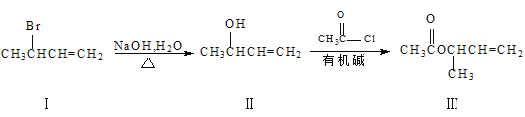
��III�����������ŵ�������___��___��
�ڸúϳ�·���еڶ�����Ӧ����___��Ӧ���Ӧ���ͣ���
��I�������������У���Ũ���Ṳ���ܵõ�CH2��CHCH��CH2����___������ţ������ʢ���Cu��������������������O2��Ӧ�ɵò���Ϊ___��
�ܢ��һ��ͬ���칹��X�ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ����������3�ֲ�ͬ��ѧ�������⡣X�Ľṹ��ʽΪ___��
���𰸡�a b c 8 5 ![]()
![]() +Br2
+Br2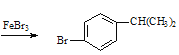 +HBr ���� ̼̼˫�� ȡ�� ��
+HBr ���� ̼̼˫�� ȡ�� �� ![]()
![]() ����OHCCH2CH2CH2CH2CHO��
����OHCCH2CH2CH2CH2CHO��
��������
��1��������ֻ��C��HԪ�أ�
�ڱ�������������Һ��Ӧ�����ױ��ܱ��������������Һ��������ʹ����ɫ��
�۳�ȥ���������е����ᣬ��ѡ����̼���ƣ������ᷴӦ���ҽ��������������ܽ�ȣ�
��2���ٱ���Ϊƽ��ṹ���뱽��ֱ��������C��ͬһƽ���ڣ���ֻ��8��Cԭ�ӹ��棻��������3�ֲ�ͬ��������ԭ�ӣ������������ֲ�ͬ��������ԭ�ӣ���˴Ź�����������5���壻
��C6H6O�в����Ͷ�![]() =4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ���
=4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ���
��������Ʊ���������������巢��ȡ����FeBr3��������
��3����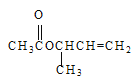 �й�������������̼̼˫����
�й�������������̼̼˫����
���ɺϳ����̿�֪����������±������ˮ�ⷴӦ����������ȡ����Ӧ��OH��CH3COȡ�����úϳ�·���еڶ�����Ӧ����ȡ����Ӧ��
�ۢ��о��ɷ�����ȥ��Ӧ���ɲ������Ļ��������ȥ��Ӧ��������ͬ����Ũ���Ṳ���ܵõ�CH2��CHCH��CH2���� ��
��
�ܻ�������һ��ͬ���칹��X�ܷ���������Ӧ�Ҳ�����ˮ�⣬X�ķ�������3�ֲ�ͬ��ѧ�������⣬X��ֻ����ȩ����û������������Ϊ�����к�3��λ�õ�H�����Է�����һ���ĶԳ��ԣ�
��1��������ֻ��C��HԪ�أ�ֻ��a���ϣ�b��c�к�OԪ�أ��ʴ�Ϊ��a��
��a. �������Ȼ���������Ӧ����������ˮ���ܶȾ���ˮ��С��������ͬ�����ܼ��𣬹�A����
b. ��������������Һ��Ӧ�����ױ��ܱ��������������Һ��������ʹ����ɫ������ͬ���ܼ��𣬹�B��ȷ��
c. ��������ˮ��Ӧ��������ȡ��������ͬ�����ܼ��𣬹�C����
��ȷ����b��
�۳�ȥ���������е����ᣬ��ѡ����̼���ƣ������ᷴӦ���ҽ��������������ܽ�ȣ���ѡc��
��2���ٱ���Ϊƽ��ṹ���뱽��ֱ��������C��ͬһƽ���ڣ�������3��ԭ�ӿɹ��棬��ֻ��8��Cԭ�ӹ��棬��������3�ֲ�ͬ��������ԭ�ӣ������������ֲ�ͬ��������ԭ�ӣ���˴Ź�����������5���塣�ʴ�Ϊ��8��5��
��C6H6O�в����Ͷ�![]() =4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ����û�����Ľṹ��ʽ��
=4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ����û�����Ľṹ��ʽ��![]() ��
��
��������Ʊ���������������巢��ȡ����FeBr3���������ʴ�Ϊ��![]() +Br2
+Br2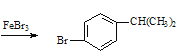 +HBr��
+HBr��
��3����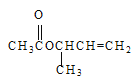 �й�������������̼̼˫����
�й�������������̼̼˫����
���ɺϳ����̿�֪����������±������ˮ�ⷴӦ����������ȡ����Ӧ��OH��CH3COȡ�����úϳ�·���еڶ�����Ӧ����ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
�ۢ��о��ɷ�����ȥ��Ӧ���ɲ������Ļ��������ȥ��Ӧ��������ͬ����Ũ���Ṳ���ܵõ�CH2��CHCH��CH2���� �� �ʴ�Ϊ����
�� �ʴ�Ϊ����
�ܻ�������һ��ͬ���칹��X�ܷ���������Ӧ�Ҳ�����ˮ�⣬X�ķ�������3�ֲ�ͬ���������⣬X��ֻ����ȩ����û������������Ϊ�����к�3��λ�õ�H�����Է�����һ���ĶԳ��ԣ���XΪ![]() ����OHCCH2CH2CH2CH2CHO����
����OHCCH2CH2CH2CH2CHO����

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д� ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�����Ŀ����1����֪Na2S2O3��H2SO4=Na2SO4��S����SO2����H2O����ͬѧͨ���ⶨ�÷�Ӧ����ʱ��Һ����ǵ�ʱ�䣬�о���������Ի�ѧ��Ӧ���ʵ�Ӱ�졣���ʵ��һ���£���ȡ��Һ�����Ϊ10 mL����
ʵ���� | ʵ���¶�/�� | c��Na2S2O3��/ ��mol��L��1�� | c��H2SO4��/ ��mol��L��1�� |
�� | 25 | 0��1 | 0��1 |
�� | 25 | 0��2 | 0��1 |
�� | 25 | 0��1 | 0��2 |
�� | 50 | 0��2 | 0��1 |
�� | 50 | 0��1 | 0��1 |
������������ʱ��̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��ʵ��____________����ʵ���ţ�����ͬʱѡ��ʵ��١�ʵ��ڡ�ʵ��ۣ��ⶨ���Һ����ǵ�ʱ�䣬��̽��______________�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2����һ���¶��£�����4a mol H2��2a mol N2����V L���ܱ������У�5 min����N2��ת����Ϊ50%����ö�ʱ����H2��ʾ�ķ�Ӧ����Ϊ______________________
ʵ�������֪2KMnO4��5H2C2O4��3H2SO4=K2SO4��2MnSO4��8H2O��10CO2�����ڿ�ʼһ��ʱ���ڣ���Ӧ���ʽ�С����Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ������������
��3�������������ijͬѧ��Ϊ�÷�Ӧ���ȣ�������Һ�¶���������Ӧ��������Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹������______________________��Ӱ�졣
��4������ʵ��֤����IJ��룬�����Ը��������Һ��������Һ�⣬�����ڷ�Ӧһ��ʼʱ����______________������ĸ��ţ���
A�������
����Ŀ��ʵ���ҴӺ����Һ������H2O ��CCl4��I2��I-�ȣ��л��յ⣬�����������£�
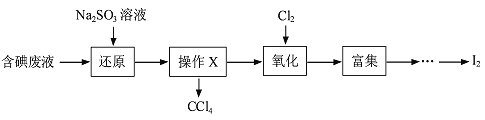
��1�����Һ�м���Na2SO3��Һ����������ԭ����Ӧ�����ӷ���ʽΪ____________��
��2����������������������ƿ�н��У���ͼһ��������Һ���������pHԼΪ2������ͨ��Cl2��ʵ����ˮԡ������40�����ҵĽϵ��¶��½��е�ԭ����_______��
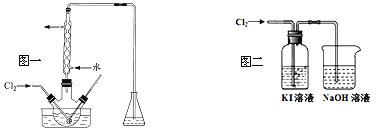
��3��ij�о�С����ͼ��װ�ö�Cl2��KI��Һ�ķ�Ӧ����̽��������ͨ��Cl2һ��ʱ���KI��Һ��Ϊ��ɫ������ͨ��Cl2������Һ��ɫ��dz������Ϊ��ɫ���о�С���������ɫ��Һ�е�Ԫ�صĴ�����̬��������¼��裺
����һ��û��I2��̬���������û��I����̬������������IO3����̬��
�������ʵ��֤������һ�������Լ���ѡ����
ʵ����� | Ԥ������ | ���� |
___________________ | ����һ���� |
������������������д������IO3�������ӷ���ʽ__________________________________��
��4�����о�С�黹�����˶Լӵ�����KIO3�����ⶨ������ʵ�飺
��ȷ��ȡ�ӵ���m g���ձ��У�������������ˮ������KI���ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250.00mL������Һ����ȡ25.00mL������Һ����ƿ�У��Ӽ��ε�����Һ����c molL-1Na2S2O3��Һ�ζ����յ㣬�ظ�3�Σ����ƽ��ֵΪV mL��
��֪��IO3��+ 5I��+6H+ =3H2O+3I2��I2 +2S2O32��=2I��+S4O62�����ⶨʱ���жϴﵽ�ζ��յ������Ϊ___________���ɲⶨ���ݿ���ø���Ʒ�к�KIO3����������Ϊ___________���ú�m��c��V�Ĵ���ʽ��ʾ��Mr��KIO3��=214 ����
���ڵζ�������ȷ���������£��ô��ֲⶨ������õĽ������ƫ�ߣ���ԭ�����ܿ�����Ӱ�죬�������ӷ���ʽ��ʾ������һӰ���ԭ��_______________________��
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������йط�Ӧ����ʽ�������ӷ���ʽ����������ȷ���ǣ�������
��֪ | ���� | |
A | ��Fe����CuSO4��Һ�У� Fe + Cu2+ = Cu + Fe2+ | ��Na���뵽CuSO4��Һ�У� 2Na + Cu2+ = Cu + 2Na+ |
B | ϡ������Ba(OH)2��Һ��Ӧ����Һ�����ԣ� 2H++SO42��+Ba2++2OH��=BaSO4��+2H2O | NaHSO4��Һ��Ba(OH)2��Һ��Ӧ�����ԣ� 2H++SO42��+Ba++2OH��=BaSO4��+2H2O |
C | ����������Ӧ2Fe+3Cl2 | ���͵��ʷ�Ӧ2Fe+3I2 |
D | ��Ca��ClO��2��Һ��ͨ������CO2�� Ca2++2ClO��+CO2+H2O=CaCO3��+2HClO | ��Ca��ClO��2��Һ��ͨ������SO2�� Ca2++2ClO��+SO2+H2O=CaSO3��+2HClO |
A.AB.BC.CD.D