题目内容
4.同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/mol.测得数据如表:下列叙述不正确的是( )| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| (1) | 2 | 3 | 0 | 27.78kJ |
| (2) | 1.6 | 1.8 | 0.8 | Q |
| A. | 容器(2)中反应开始时v(正)>v(逆) | |
| B. | 容器(1)、(2)中反应达平衡时压强相等 | |
| C. | 容器(2)中反应达平衡时,吸收的热量Q为9.26 kJ | |
| D. | 若条件为“绝热恒容”,容器(1)中反应达平衡时n (NH3)<0.6 mol |
分析 A.根据等效平衡知识来分析判断;
B.根据Qc和K之间的大小关系来判断化学反应的方向;
C.从平衡移动的角度比较反应放出的热量与9.26kJ的关系;
D.“绝热恒容”容器中,放热反应会导致体系的温度升高,根据温度对平衡的影响来回答.
解答 解:A.从等效平衡的角度分析,1.6molN2、1.8molH2和0.8molNH3相当2molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内压强相等,故A正确;
B.N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/mol
初始浓度:2 3 0 92.6kJ
变化浓度:$\frac{1}{3}$ 1 $\frac{2}{3}$ 27.78kJ
平衡浓度:$\frac{5}{3}$ 2 $\frac{2}{3}$
平衡常数K=$\frac{(\frac{2}{3})^{2}}{\frac{5}{3}×{2}^{3}}$=0.1,容器(2)中反应开始时,Qc=$\frac{0.{8}^{2}}{1.6×1.{8}^{3}}$>K,所以反应逆向移动,v(正)<v(逆),故B错误;
C.容器(2)中反应逆向进行达平衡,所以吸收热量,(1)和(2)的平衡常数是一样的,所以容器(2)中反应达平衡时,吸收的热量Q为 $\frac{1}{3}$×27.78kJ=9.26kJ,故C正确;
D.条件为“绝热恒容”,容器(1)中反应进行中,温度会升高,化学平衡会逆向移动,所以达平衡时n(NH3)<0.6mol,故D正确;
故选B.
点评 本题考查化学平衡的计算,题目难度中等,注意从等效平衡的角度分析,为该题的易错点,试题培养了学生的分析能力及化学计算能力.

| A. | 字航员喝茶时注入的H2O的摩尔质量是18克 | |
| B. | H2O+Cl2?HCl+HClO这反应属于氧化还原反应 | |
| C. | 氢的三种同位素1H、2D、3T与18O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 1-丁烯 | D. | 2-戊烯 |
| A. | 苯与液溴在FeBr3催化作用下生成溴苯的反应 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2 | |
| C. | 乙酸与乙醇生成乙酸乙酯的反应 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷的反应 |
| A. | 标准状况下,2.24LC2H5OH中含有的C-H键数目为0.5NA | |
| B. | 5.6g铁粉与一定量的稀硝酸反应失去的电子数目一定为0.3NA | |
| C. | 28g乙烯与环丙烷的混合气体中含有的原子总数为6NA | |
| D. | 1.0L pH=1的硫酸溶液中含有的H+数目为0.2NA |
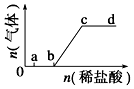 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| C. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
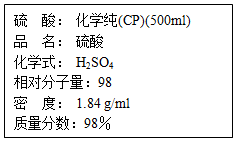 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: