题目内容
3.恒温下,将一定量的N2和H2的混合气体通入一个固定容积的容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
弱反应进行到某时刻,测的N2的物质的量为13mol,NH3的物质的量为6mol,求N2起始时物质的量.
分析 NH3的物质的量为6mol,设参加反应的氮气的物质的量为x,则
N2(g)+3H2(g)?2NH3(g)
1 2
x 6mol
解得x,氮气的起始时物质的量=x+剩余氮气的物质的量,以此来解答.
解答 解:NH3的物质的量为6mol,设参加反应的氮气的物质的量为x,则
N2(g)+3H2(g)?2NH3(g)
1 2
x 6mol
$\frac{1}{2}=\frac{x}{6mol}$,
解得x=3mol,
某时刻,测的N2的物质的量为13mol,
可知氮气的起始时物质的量=3mol+13mol=16mol,
答:N2起始时物质的量为16mol.
点评 本题考查化学平衡的计算,为高频考点,把握反应中物质的量关系及氮气的物质的量计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
13.“试玉要烧三日满,辨材须待七年期”是唐代诗人白居易的名句,下列有关“玉”的说法正确的是( )
| A. | 玉是石灰石 | B. | 玉的硬度比河砂大 | ||
| C. | 玉的熔点较高 | D. | 玉是金刚砂 |
14.下列化学用语正确的是( )
| A. | 硫原子结构示意图: | |
| B. | 氯化氢分子的电子式: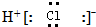 | |
| C. | 乙烯分子的结构式:CH2=CH2 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=2 Fe3++3SO42ˉ |
11.甲、乙、丙、丁4种无机化合物均含有2种元素,分子中均含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 | |
| C. | 丙中含有ⅣA族元素,则相同条件下丙比甲稳定 | |
| D. | 若丁分子空间构型为三角锥型,则丁分子间存在氢键 |
18.-NO2取代二甲苯苯环上的氢原子,可得到的同分异构体的数目共有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
8.近期,科学家研制出多种新型杀虫剂代替DDT,其中一种简式如图所示,下列关于该有机物的说法正确的是( )
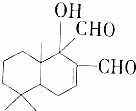

| A. | 既能发生氧化反应,又能发生酯化反应 | |
| B. | 与FeC13溶液发生反应后,溶液显紫色 | |
| C. | 1mol该有机物最多可与2molCu(0H)2反应 | |
| D. | 1mol该有机物最多可与1molH2加成 |
3.NH4HS(s)?NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是( )
| A. | 温度、容积不变,充入NH3 | B. | 温度、容积不变时,充入SO2气体 | ||
| C. | 充入N2,保持压强不变 | D. | 移走一部分NH4HS固体 |
1.锌作为人体必须的微量元素之一,当人体缺锌时,经常用补食硫酸锌的方式调整.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意图如下:
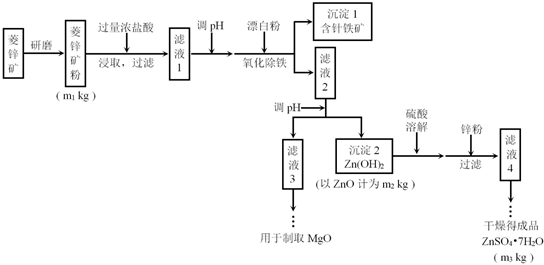
(1)加过量稀盐酸的目的是提高锌元素的浸出率.
(2)完成“氧化除铁”步骤中反应的离子方程式:
2Fe(OH)2+ClO-+H2O═2Fe(OH)3+1Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
(5)工业上从“滤液3”制取MgO过程中,最适合的反应物是b(选填序号).
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析流程图中的数据,菱锌矿粉中ZnCO3的质量分数不低于$\frac{125m2}{81m1}$×100%.

(1)加过量稀盐酸的目的是提高锌元素的浸出率.
(2)完成“氧化除铁”步骤中反应的离子方程式:
2Fe(OH)2+ClO-+H2O═2Fe(OH)3+1Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析流程图中的数据,菱锌矿粉中ZnCO3的质量分数不低于$\frac{125m2}{81m1}$×100%.