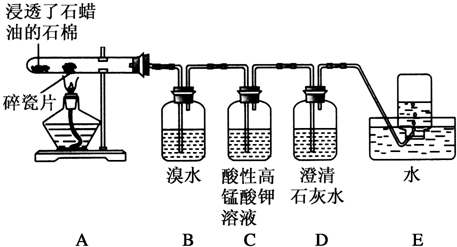
题目内容
3.NH4HS(s)?NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是( )| A. | 温度、容积不变,充入NH3 | B. | 温度、容积不变时,充入SO2气体 | ||
| C. | 充入N2,保持压强不变 | D. | 移走一部分NH4HS固体 |
分析 A.容积不变,充入氨气,平衡逆向进行;
B.温度、容积不变时,通入SO2气体,与硫化氢反应生成S,硫化氢的浓度降低,据此分析解答;
C.充入氮气,保持压强不变,体积增大,反应气体混合物各组分的浓度降低,平衡向体积增大的方向移动.
D.NH4HS为固体,改变NH4HS固体的用量,不影响平衡移动.
解答 解:A.容积不变,充入氨气,增大生成物浓度,平衡向左移动,故A不符合;
B.温度、容积不变时,通入SO2气体,与硫化氢反应生成S,硫化氢的浓度降低,平衡向正反应方向移动,故B不符合;
C.充入氮气,保持压强不变,体积增大,反应气体混合物各组分的浓度降低,压强降低,平衡向正反应方向移动,故C不符合;
D.NH4HS为固体,改变NH4HS固体的用量,不影响平衡移动,故D符合;
故选D.
点评 本题考查外界条件对化学平衡的影响,难度不大,注意理解压强对化学平衡移动的影响本质是影响反应混合物的浓度进而影响反应速率导致平衡移动.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 发生了颜色变化的一定是化学变化 | |
| B. | 有气泡产生或固体析出的变化一定是化学变化 | |
| C. | 用糯米、酒曲和水制成甜酒酿一定是化学变化 | |
| D. | 氧化还原反应中肯定有一种元素被氧化,而另一种元素被还原 |
15.下列叙述中,正确的是( )
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 氧化还原反应中所有元素的化合价都发生变化 |
 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
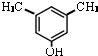 或
或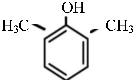 .
.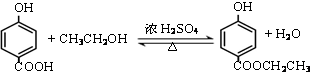 .
. 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.