题目内容
17.室温下,在pH=12的某溶液中,由水电离的[OH-]为( )①1.0×10-7mol•L-1
②1.0×10-6mol•L-1
③1.0×10-2mol•L-1
④1.0×10-12mol•L-1.
| A. | 只有① | B. | ①或② | C. | 只有④ | D. | ③或④ |
分析 室温时,Kw=1×10-14,则pH=12的某溶液中c(H+)=1×10-12mol/L,c(OH-)=1×10-2mol/L,可为碱溶液,也可能为强碱弱酸盐溶液.
分类讨论.
解答 解:室温时,Kw=1×10-14,则pH=12的某溶液中c(H+)=1×10-12mol/L,c(OH-)=1×10-2mol/L,可为碱溶液,也可能为强碱弱酸盐溶液.
①若为碱溶液,则氢离子全部来自于水的电离,而水电离出的氢离子和氢氧根的浓度相等.故溶液中水电离出的c(OH-)=c(H+)=1×10-12mol/L,故④正确;
②若为强碱弱酸盐溶液,氢离子和氢氧根全部来自于水的电离,但由于氢离子被结合,故溶液中的氢氧根的浓度是水电离出的全部,故水电离出的c(OH-)=1×10-2mol/L,故③正确.
故选D.
点评 本题考查PH的简单计算和分类讨论的思想,题目难度不大,注意酸碱溶液和盐溶液中氢离子、氢氧根的来源.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
7.下列物质属于离子化合物且含有共价键的是( )
| A. | KOH | B. | MgCl2 | C. | HCl | D. | N2 |
8.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol•L-1 CH3COONa溶液:Mg2+、H+、Cl-、SO42+ | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
2.著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3+NaCl+CO2+H2O═NaHCO3↓+NH4Cl
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
今在40℃时,向434g饱和食盐水中通入44.8L(标准状况)NH3,再向溶液中通入过量的CO2,求:
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
9.锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中.下列说法正确的是( )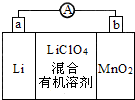

| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-=MnO2- | |
| C. | 用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度 | |
| D. | Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 |
6.能在水溶液中大量共存的离子组是( )
| A. | H+、Fe3+、SO42-、I- | B. | H+、NH4+、HCO3-、NO3- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | Ag+、K+、Cl-、SO42- |
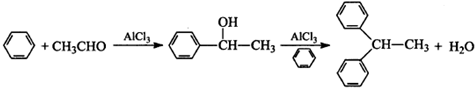
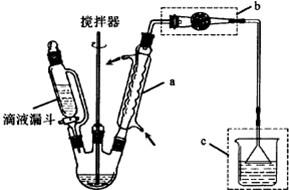
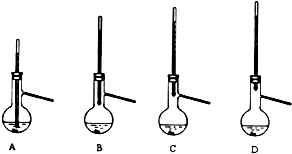
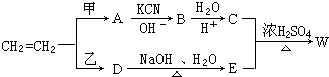
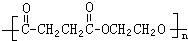 .
.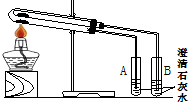 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.