��Ŀ����
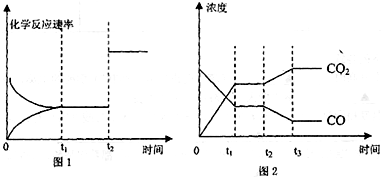
���з�ӦCO��g��+H2O��g��?CO2��g��+H2��g����H=-43KJ/mol����850��ʱ��K=1������ij�ܱ������г���1.0molCO��3.0molH2O��1.0molCO2 xmolH2������˵������ȷ���ǣ�������
������A����Ӧ�Ƿ��ȷ�Ӧ��ƽ�ⳣ�����¶ȱ仯���¶�����ƽ��������У�ƽ�ⳣ����С��
B������Ũ���̺�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���������
C�����ַ�Ӧ�����һ�����ʣ��������һ�����ʵ�ת���ʣ�����ת���ʼ�С��
D����Ӧ��ʼʱ������Ӧ������У�Q��K���������
B������Ũ���̺�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���������
C�����ַ�Ӧ�����һ�����ʣ��������һ�����ʵ�ת���ʣ�����ת���ʼ�С��
D����Ӧ��ʼʱ������Ӧ������У�Q��K���������
����⣺A����Ӧ�Ƿ��ȷ�Ӧ��ƽ�ⳣ�����¶ȱ仯���¶�����ƽ��������У�ƽ�ⳣ����С��900��C���÷�Ӧ��ƽ�ⳣ��K��1����A��ȷ��
B��850��Cʱ����x=5.0��Q=
=
=
��K=1������ʼʱƽ�����淴Ӧ�����ƶ�����B��ȷ��
C�����ַ�Ӧ�����һ�����ʣ��������һ�����ʵ�ת���ʣ�����ת���ʼ�С��850��C�ﵽƽ��ʱ��ͨ��CO��COת���ʽ���С����C����
D��850��Cʱ����Ҫʹ������Ӧ��ʼʱ������Ӧ������У�Q=
=
��K=1����xӦ����0��x��3����D��ȷ��
��ѡC��
B��850��Cʱ����x=5.0��Q=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 1.0��5.0 |
| 1.0��3.0 |
| 5 |
| 3 |
C�����ַ�Ӧ�����һ�����ʣ��������һ�����ʵ�ת���ʣ�����ת���ʼ�С��850��C�ﵽƽ��ʱ��ͨ��CO��COת���ʽ���С����C����
D��850��Cʱ����Ҫʹ������Ӧ��ʼʱ������Ӧ������У�Q=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 1.0x |
| 1.0��3.0 |
��ѡC��
���������⿼���˻�ѧƽ�ⳣ��������ͼ���Ӧ�ã�ת���ʵķ����жϣ�����ƽ�ⳣ���ļ�����жϷ�����ƽ���ƶ� ԭ���ǽ���ؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
�����Ŀ
 A������ѡѧ����ѧ�������������
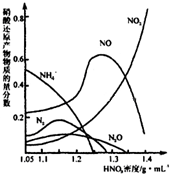
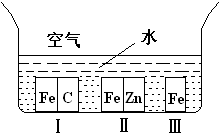
A������ѡѧ����ѧ���������������1������ͼ��ʾ�������ڢ����ֲ�ͬ�Ļ����У�������ʴ�������ɴ�С��˳����
��2�����ȴ�����һ���ƻ�����������ʣ��ڴ���ƽ�����У����ȴ����������ߵ�����ֽ����ԭ�ӣ���ԭ�Ӳ��������йط�Ӧ��
��Cl+O3��ClO+O2����O3��O+O2����ClO��Cl+O2
���з�Ӧ���ܷ�Ӧʽ��
��3��̼�������dz��������ɼ�����Ҫ����Ϊ���ڼ��������²��������壬ʹʳƷ������ɣ���д��̼���������ȷֽ�Ļ�ѧ����ʽ
��4��������Դ���ķ�����
A������ B������ C���ѷʷ� D��������շ�
B����ѡѧ����ѧ��Ӧԭ������������
�跴Ӧ��Fe��s��+CO2��g���TFeO��s��+CO��g����ƽ�ⳣ��ΪK1����Ӧ��Fe��s��+H2O��g���TFeO��s��+H2��g����ƽ�ⳣ��K2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
��2�����з�Ӧ��CO2��g��+H2��g���TCO��g��+H2O��g��д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����ʽ��K3�T
��3����д�Ȼ�ѧ����ʽ��
��1mol N2��g��������O2��g����Ӧ������NO2��g��������68KJ������
��NH3��g��ȼ������NO2��g����H2O��g������֪
��1��2H2��g��+O2��g���T2H2O��g����H�T-483.6kJ/mol
��2��N2��g��+2O2��g���T2NO2��g����H�T+67.8kJ/mol
1��N2��g��+3H2��g���T2NH3��g����H�T-92.0kJ/mol
NH3��g��ȼ������NO2��g����H2O ��g���Ȼ�ѧ����ʽ��