题目内容
19.A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):A$\stackrel{+O_{2}}{→}$B$\stackrel{+O_{2}}{→}$C$\stackrel{+H_{2}O}{→}$D.(1)若A、D的水溶液均呈酸性,且D为强酸.
①则A、D分别为A:H2S,D:H2SO4.(填写化学式,下同)
②简述检验B物质的方法将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色.
③写出D的浓溶液和Cu在加热条件的化学方程式2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)若A金属,D为强碱,则
①C的化学式为Na2O2,等物质的量的B和C中所含离子的物质的量相等(填写相等或不相等).
②在C→D的化学反应中,还原剂是Na2O2,1摩尔C完全反应转移电子的物质的量为1mol.
分析 (1)若A、D的水溶液均呈酸性,且D为强酸,S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4;
(2)若A金属,D为强碱,则A为Na,B为Na2O,C为Na2O2,D为NaOH.
解答 解:(1)①若A、D的水溶液均呈酸性,且D为强酸,S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4,故答案为:H2S;H2SO4;
②简述检验SO2物质的方法:将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色,
故答案为:将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色;
③硫酸的浓溶液和Cu在加热条件的化学方程式:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)若A金属,D为强碱,则A为Na,B为Na2O,C为Na2O2,D为NaOH.
①C的化学式为:Na2O2,等物质的量的Na2O和Na2O2中所含离子的物质的量之比为1:1,含有离子数目相等,
故答案为:Na2O2;相等;
②C→D的化学反应为2Na2O2+2H2O=4NaOH+O2↑,反应过氧化钠既是氧化剂又是还原剂,各占$\frac{1}{2}$,1摩尔Na2O2完全反应转移电子的物质的量为1mol×$\frac{1}{2}$×2=1mol,
故答案为:Na2O2;1mol.
点评 本题考查无机物推断,涉及Na、S等元素单质及化合物的转化,难度中等,旨在考查学生对元素化合物知识熟练掌握,注意掌握中学常见的连续反应.

练习册系列答案
相关题目
9.下列情况中属于离子反应的是( )
| A. | H2和O2反应生成了H2O | B. | Zn粒投入稀硫酸中 | ||
| C. | KMnO4加热制O2 | D. | C和O2反应生成CO2 |
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | 氢氧化钠 | C. | 盐酸 | D. | 豆浆 |
7.下列物质分类正确的是( )
| A. | SO2、SO3、CO2均为酸性氧化物 | |
| B. | 稀豆浆、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 氨水、漂白粉、氢氟酸、小苏打均为纯净物 |
14.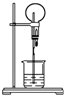 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |
4.短周期元素A、B、C、D的原子序数依次增大,A和C同主族,B和D同主族,原子半径A小于B,四种元素原子最外层电子数之和为14.下列叙述正确的是( )
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
8.下列有关说法错误的是( )
| A. | 过氧化氢酶、酚醛树脂、尼龙、有机玻璃、PVC都是高分子化合物 | |
| B. | 分子筛、青花瓷、黏土、硅藻土的主要成分都是硅酸盐 | |
| C. | 植物秸秆发酵制沼气、玉米制乙醇、城市与工业有机废弃物的再利用都涉及生物质能 | |
| D. | 酸碱质子理论进一步扩大了人们对酸碱的认识,可以解释一些非水溶液中进行的酸碱反应 |
9.已知NaHCO3溶液呈碱性,在NaHCO3溶液中,下列说法正确的是( )
| A. | HCO3-的水解程度大于电离程度 | B. | HCO3-的水解程度小于电离程度 | ||
| C. | HCO3-的水解程度等于电离程度 | D. | 不能确定 |

