题目内容
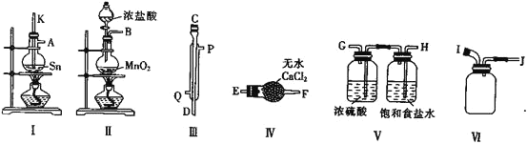
【题目】现有某铁碳合金(可看作铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中碳的质量分数,设计了如图所示的实验装置(夹持仪器已省略)。
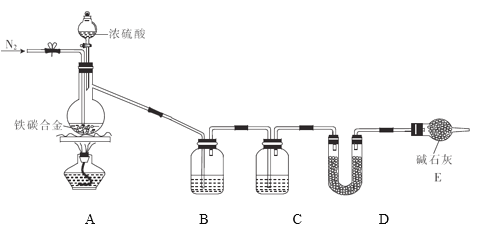
(1)装置A中发生的反应除外![]() ,还有________________。
,还有________________。
(2)请完成下列表格:
装置代号 | B | C | D |
所盛试剂 | 酸性 | ①________ | ②____________ |
装置作用 | ③_____________ | 干燥气体 | ④___________ |
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g,则合金中碳的质量分数为_______,若缺少E装置,则所测碳的质量分数_________(填“偏高”“偏低”或“无影响”)。
【答案】![]()
![]() 碱石灰 吸收
碱石灰 吸收![]() 吸收
吸收![]() 3.6% 偏高
3.6% 偏高
【解析】
装置A中发生反应铁和浓硫酸加热反应生成硫酸铁、二氧化硫和水,碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,通过装置B中高锰酸钾溶液吸收二氧化硫气体,通过装置C中的浓硫酸干燥气体,通过装置D中碱石灰吸收二氧化碳气体,装置E是防止空气中二氧化碳、水蒸气进入装置D影响测定结果;
(1)铁和浓硫酸加热反应生成硫酸铁、二氧化硫和水,碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水;
(2)反应生成的二氧化硫、二氧化碳、水蒸气通过装置B中高锰酸钾溶液吸收二氧化硫气体,通过装置C中的浓硫酸干燥气体,通过装置D中碱石灰吸收二氧化碳气体,装置E是防止空气中二氧化碳、水蒸气进入装置D影响测定结果;
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g为二氧化碳的质量,物质的量=![]() = 0.015mol,则碳元素守恒计算得到,合金中碳的质量分数,若缺少E装置,空气中水蒸气和二氧化碳进入装置D使二氧化碳质量增大;
= 0.015mol,则碳元素守恒计算得到,合金中碳的质量分数,若缺少E装置,空气中水蒸气和二氧化碳进入装置D使二氧化碳质量增大;
(1)装置A中发生反应是铁和浓硫酸加热反应生成硫酸铁、二氧化硫和水,碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:![]() ;
;![]() ;
;
答案为:![]() ;
;
(2)反应生成的二氧化硫、二氧化碳、水蒸气通过装置B中高锰酸钾溶液吸收二氧化硫气体,通过装置C中的浓硫酸干燥气体,通过装置D中碱石灰吸收二氧化碳气体,装置E是防止空气中二氧化碳、水蒸气进入装置D影响测定结果;
答案为:碱石灰;吸收SO2;吸收CO2;
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g为二氧化碳的质量,物质的量=![]() =0.015mol,则碳元素守恒计算得到,合金中碳的质量分数=
=0.015mol,则碳元素守恒计算得到,合金中碳的质量分数=![]() ×100%=3.6%,若缺少E装置,空气中水蒸气和二氧化碳进入装置D使二氧化碳质量增大,测定结果偏高;
×100%=3.6%,若缺少E装置,空气中水蒸气和二氧化碳进入装置D使二氧化碳质量增大,测定结果偏高;
答案为:3.6%;偏高。

 云南师大附小一线名师提优作业系列答案
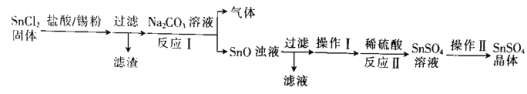
云南师大附小一线名师提优作业系列答案【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡![]() 熔点
熔点![]() 与
与![]() 反应制备
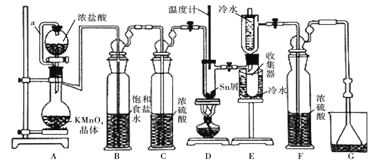
反应制备![]() ,装置如图。
,装置如图。
已知:![]() 、
、![]() 有关物理性质:
有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
![]() 极易水解生成
极易水解生成![]() 。回答下列问题:
。回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是![]() ________;
________;![]() ______
______
(3)若上述装置中缺少装置![]() 其它均相同
其它均相同![]() ,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)![]() 和锡的反应产物有
和锡的反应产物有和
![]() ,为防止产品中带入过多的
,为防止产品中带入过多的![]() ,可采取的措施是____________________________________________。
,可采取的措施是____________________________________________。
(5)滴定分析产品中2价![]() Ⅱ
Ⅱ![]() 的含量:用分析天平称取
的含量:用分析天平称取![]() 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用
产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用![]() 的碘标准溶液滴定至终点时消耗
的碘标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() Ⅱ
Ⅱ![]() 的质量分数为___________。
的质量分数为___________。![]() 小数点后保留2位,已知
小数点后保留2位,已知![]()
【题目】高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________。
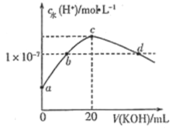
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为________。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________。