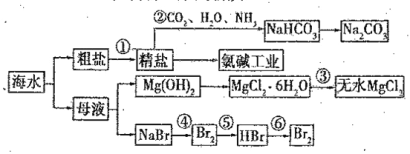
题目内容
【题目】某化学兴趣小组拟实验探究锡及锡的化合物的部分性质。经查阅资料知:Sn的熔点为![]() ;
;![]() 易被氧化,且易水解;
易被氧化,且易水解;![]() 常温下易分解,
常温下易分解,![]() 常温下为无色液体,熔点为
常温下为无色液体,熔点为![]() ,沸点为
,沸点为![]() ,回答下列问题:
,回答下列问题:
(1)该小组用以下流程制备![]() 晶体:
晶体:
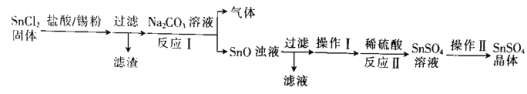
![]() 加入锡粉的作用为______________________________________。
加入锡粉的作用为______________________________________。
![]() 反应Ⅰ的离子方程式为______________________________。
反应Ⅰ的离子方程式为______________________________。
![]() 操作Ⅰ为沉淀的洗涤,请简述如何判断沉淀是否洗涤干净:_____________________。
操作Ⅰ为沉淀的洗涤,请简述如何判断沉淀是否洗涤干净:_____________________。
(2)用熔融的锡与干燥的氯气制备![]() ,实验装置如下:
,实验装置如下:
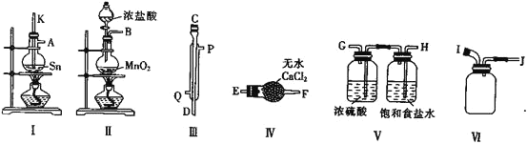
![]() 装置Ⅲ为冷凝管,则水流从__________
装置Ⅲ为冷凝管,则水流从__________![]() 填“Q”或“P”
填“Q”或“P”![]() 口进入。
口进入。
![]() 请用大写英文字母表示的接口按从左到右顺序组装仪器:__________________________。
请用大写英文字母表示的接口按从左到右顺序组装仪器:__________________________。
![]() 整个装置存在的不足之处为_________________________。
整个装置存在的不足之处为_________________________。
(3)该小组通过下列方法测定所用锡粉的纯度:取产品![]() 溶于稀硫酸中,加入过量的
溶于稀硫酸中,加入过量的![]() 溶液,再用
溶液,再用![]() 的
的![]() 溶液滴定
溶液滴定![]() ,消耗
,消耗![]() 溶液
溶液![]() 。已知
。已知![]() ,
,![]() ,
,![]() 。则锡粉的质量分数为
。则锡粉的质量分数为![]() 杂质不参与反应
杂质不参与反应![]() ______________
______________![]() 结果保留三位有效数字
结果保留三位有效数字![]() 。
。
【答案】防止![]() 被氧化
被氧化 ![]() 取最后一次洗涤液少许于试管中,滴入用
取最后一次洗涤液少许于试管中,滴入用![]() 酸化的
酸化的![]() 溶液,若无明显现象,则证明沉淀已洗涤干净,否则未洗涤干净
溶液,若无明显现象,则证明沉淀已洗涤干净,否则未洗涤干净 ![]()
![]() 缺少尾气处理装置
缺少尾气处理装置 ![]() 。
。
【解析】
(1)![]() 易水解,反应在无水环境下进行,Ⅱ中发生的反应是:
易水解,反应在无水环境下进行,Ⅱ中发生的反应是:![]() 浓
浓![]() ,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,Ⅲ中试剂A为饱和食盐水除去氯气中的HCl,浓硫酸吸收水蒸气,干燥的氯气与Sn在Ⅳ反应生成
,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,Ⅲ中试剂A为饱和食盐水除去氯气中的HCl,浓硫酸吸收水蒸气,干燥的氯气与Sn在Ⅳ反应生成![]() ,未反应的氯气,用氢氧化钠溶液吸收,干燥管中氯化钙吸收水蒸气,防止加入Ⅵ中使产物水解,以此解答该题。
,未反应的氯气,用氢氧化钠溶液吸收,干燥管中氯化钙吸收水蒸气,防止加入Ⅵ中使产物水解,以此解答该题。
![]() 易被氧化,加入锡粉是为了防止
易被氧化,加入锡粉是为了防止![]() 被氧化;
被氧化;
![]() 反应Ⅰ是
反应Ⅰ是![]() 与碳酸钠反应生成
与碳酸钠反应生成![]() 和氯化钠,反应的离子方程式为
和氯化钠,反应的离子方程式为![]() ;
;
![]() 由于沉淀表面可能附有氯离子,检验最后一次洗涤液中是否含有氯离子即可,具体操作是:取最后一次洗涤液少许于试管中,滴入用
由于沉淀表面可能附有氯离子,检验最后一次洗涤液中是否含有氯离子即可,具体操作是:取最后一次洗涤液少许于试管中,滴入用![]() 酸化的
酸化的![]() 溶液,若无明显现象,则证明沉淀已洗涤干净,否则未洗涤干净;
溶液,若无明显现象,则证明沉淀已洗涤干净,否则未洗涤干净;
![]() 冷凝时逆流冷凝效果好,所以应该下进上出,选Q;
冷凝时逆流冷凝效果好,所以应该下进上出,选Q;
![]() 易水解,反应应在无水环境下进行进行,Ⅱ中发生反应:
易水解,反应应在无水环境下进行进行,Ⅱ中发生反应:![]() 浓
浓![]() ,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,Ⅲ中试剂A为饱和食盐水除去HCl,浓硫酸吸收水蒸气,氯气与Sn在Ⅰ反应生成
,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,Ⅲ中试剂A为饱和食盐水除去HCl,浓硫酸吸收水蒸气,氯气与Sn在Ⅰ反应生成![]() ,未反应的氯气,用氢氧化钠溶液吸收,防止污染空气,干燥管中氯化钙吸收水蒸气,防止空气中的水蒸气进入Ⅵ中使产物水解,其连接顺序为BHGKACDIJEF;
,未反应的氯气,用氢氧化钠溶液吸收,防止污染空气,干燥管中氯化钙吸收水蒸气,防止空气中的水蒸气进入Ⅵ中使产物水解,其连接顺序为BHGKACDIJEF;
![]() 由于氯气有毒,排放易造成空气污染,缺少尾气处理装置;
由于氯气有毒,排放易造成空气污染,缺少尾气处理装置;
![]() 发生的反应分别为
发生的反应分别为![]() ,
,![]() ,
,![]() 由方程式
由方程式![]() 得知
得知![]() ,
,![]() ,
,![]() ,
,
锡粉样品中锡的质量分数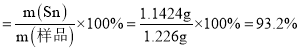 ;
;

【题目】以炼锌厂的烟道灰![]() 主要成分为ZnO,另含少量
主要成分为ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
请问答下列问题:
(1)滤渣A的主要成分为_________,滤渣B的主要成分为_______________。
(2)除锰过程中产生![]() 沉淀的离子方程式为_______________________。
沉淀的离子方程式为_______________________。
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制反应液pH的范围为______________。
时加入ZnO控制反应液pH的范围为______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,请设计实验证明
,请设计实验证明![]() 的存在。________。
的存在。________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_______________。
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,![]() 范围内,发生反应的化学方程式为_________________。
范围内,发生反应的化学方程式为_________________。

【题目】现有某铁碳合金(可看作铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中碳的质量分数,设计了如图所示的实验装置(夹持仪器已省略)。
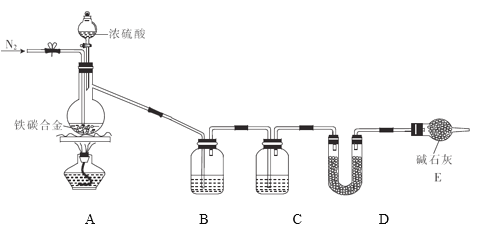
(1)装置A中发生的反应除外![]() ,还有________________。
,还有________________。
(2)请完成下列表格:
装置代号 | B | C | D |
所盛试剂 | 酸性 | ①________ | ②____________ |
装置作用 | ③_____________ | 干燥气体 | ④___________ |
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g,则合金中碳的质量分数为_______,若缺少E装置,则所测碳的质量分数_________(填“偏高”“偏低”或“无影响”)。