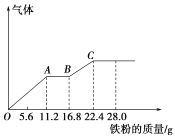
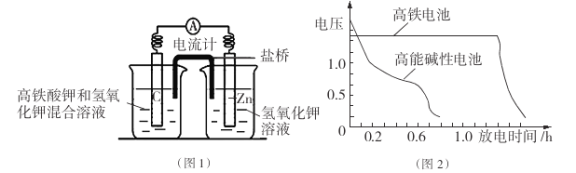
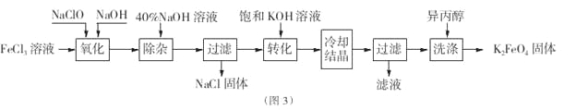
题目内容
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度
①取水样20.0mL于锥形瓶,加入10.0 mLKI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01 mol·L-1的Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3 =2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是______________。
(2) 步骤②应使用____________式滴定管。
(3)试描述滴定终点的现象:_______________________________。
(4)若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为______________ 。
(5)请指出实验中的一处明显错误:_______________________________。
【答案】(1)淀粉溶液;(2)碱;
(3)滴入最后一滴Na2S2O3溶液。待测液恰好由蓝色变为无色且30s不再变化
(4)0.005mol·L-1
(5)步骤②滴定管用蒸馏水洗净后未用待测液润洗
【解析】
试题分析:(1) 加入KI溶液有单质碘生成,加入淀粉溶液呈蓝色,所以指示剂是淀粉溶液;(2)Na2S2O3溶液呈碱性,所以用碱式滴定管;(3)试描述滴定终点的现象滴入最后一滴Na2S2O3溶液。待测液恰好由蓝色变为无色且30s不再变化;
(4)根据关系式

C=0.005mol·L-1
(5)步骤②滴定管用蒸馏水洗净后未用待测液润洗。

【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
能量/kJmol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。