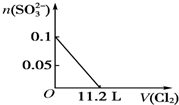
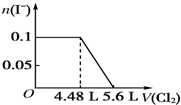
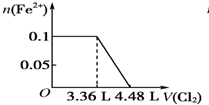
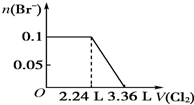
题目内容
6.(1)写出以硫铁矿为原料生产硫酸的过程中发生的主要反应的化学方程式4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2;2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;SO3+H2O=H2SO4(2)足量Zn与一定量浓H2SO4反应,开始的反应的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,后期反应的离子方程式:Zn+2H+=H2↑+Zn2+
(3)Na2SO3溶液中通入O2反应的离子方程式为2SO32-+O2=2SO42-
(4)Na2SO3溶液与H2SO4反应的化学方程式为SO32-+2H+=H2O+SO2↑.
分析 (1)硫铁矿和氧气反应生成氧化铁和二氧化硫气体,二氧化硫与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸;
(2)锌与浓硫酸反应生成硫酸锌、二氧化硫和水;锌与稀硫酸反应生成硫酸锌和氢气;
(3)亚硫酸钠与氧气反应生成硫酸钠;
(4)亚硫酸钠与硫酸反应生成硫酸钠和二氧化硫和水.
解答 解:(1)硫铁矿和氧气反应生成氧化铁和二氧化硫气体,化学方程式:4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2;二氧化硫与氧气反应生成三氧化硫,化学方程式:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;三氧化硫与水反应生成硫酸,化学方程式:SO3+H2O=H2SO4;
故答案为:4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2;2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;SO3+H2O=H2SO4;
(2)锌与浓硫酸反应生成硫酸锌、二氧化硫和水,化学方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;锌与稀硫酸反应生成硫酸锌和氢气,离子方程式:Zn+2H+=H2↑+Zn2+;
故答案为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;Zn+2H+=H2↑+Zn2+;
(3)亚硫酸钠与氧气反应生成硫酸钠,离子方程式:2SO32-+O2=2SO42-;
故答案为:2SO32-+O2=2SO42-;
(4)亚硫酸钠与硫酸反应生成硫酸钠和二氧化硫和水,离子方程式:SO32-+2H+=H2O+SO2↑;
故答案为:SO32-+2H+=H2O+SO2↑;
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质是解题关键,注意硫酸与锌反应时,浓度不同发生反应不同,题目难度不大.

| A. | $\frac{m}{a}L$ | B. | $\frac{2m}{3a}L$ | C. | $\frac{m+n}{a}L$ | D. | $\frac{2(m+n)}{3a}L$ |
(1)NOx是汽车尾气中的主要污染物之一.
①NOx形成的酸雨被称为硝酸型酸雨,硝酸型酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时高温电火花会引发N2和O2反应,反应的化学方程式是N2+O2 $\frac{\underline{\;放电\;}}{\;}$2NO.
(2)因SO2的大量排放形成的酸雨被称为硫酸型酸雨,我国的酸雨主要是硫酸型酸雨.取硫酸型酸雨样品置于空气中,一段时间后发现该酸雨的酸性增强了,你认为原因是:2H2SO3+O2=2H2SO4(用化学方程式表示).
(3)为减少SO2的排放,常采取一些有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是CaSO4.
②下列物质中,可用于吸收烟气中的SO2的是ad(填序号).
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3•H2O
(4)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如下:
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
| A. | CuSO4•3H2O | B. | CuSO4•2H2O | C. | CuSO4•H2O | D. | CuSO4 |
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 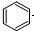 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$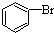 +HBr +HBr |