题目内容
15.乙烯是一种重要的化工原料.乙烯燃烧的化学方程式为C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,下列关于该反应的说法中,正确的是( )| A. | 反应过程中吸收大量的热 | |
| B. | 反应前后原子个数不变 | |
| C. | 该反应属于置换反应 | |
| D. | 参加反应的乙烯和氧气的质量比为9:24 |
分析 乙烯燃烧应该放热,化学反应前后各种原子的个数不会增减,此反应属氧化反应,且利用各物质的相对分子质量可求各物质间的量的关系.
解答 解:A、物质的燃烧一定放热,故A错误;
B、任何反应都具有原子个数不变的性质,故B正确;
C、由于反应物是两种,其中一种是单质,生成物也是两种,但没有单质生成,不符合置换反应“一换一”特点,故C错误;
D、参加反应的乙烯与氧气的质量比是:(12×2+4):(6×16)=7:24,故D错误;
故选B.
点评 此题是对化学反应相关问题的考查,解题的关键是对化学反应方程式的意义有较全面的了解,属基础知识考查题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
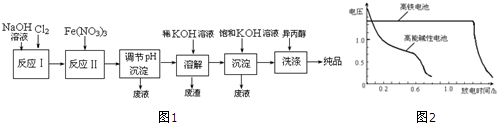
5.高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图1所示:
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.

6.立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
实验中可选用的试剂:30% H2O2、3.0mol•L-1 H2SO4、1.0mol•L-1 NaOH.
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.
3.根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2,
(4)H2S+I2=S+2HI.
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2,
(4)H2S+I2=S+2HI.
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |
10.对标准状况下的四种气体的关系从小到大表示不正确的是( )
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
20.下列属于同系物的是( )
①金刚石与“足球烯”C60
②D与T
③16O、17O和18O
④氧气(O2)与臭氧(O3)
⑤CH4和CH3CH2CH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑦ 和
和
⑧ 和
和
①金刚石与“足球烯”C60
②D与T
③16O、17O和18O
④氧气(O2)与臭氧(O3)
⑤CH4和CH3CH2CH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑦
 和
和
⑧
 和
和
| A. | ①④ | B. | ⑤⑦ | C. | ⑥⑧ | D. | ②③ |
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol H2O中含有的原子数为NA | |
| B. | 2g H2中含有的氢原子数为2NA | |
| C. | 常温常压下,11.2L N2中含有的分子数为0.5N A | |
| D. | 1L 0.1 mol/L NaNO3溶液中含有的钠离子数为NA |
4.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA | |
| B. | 由2H和18O所组成的水11 g,其中所含的中子数为4NA | |
| C. | 常温下丁烯和环丙烷组成的42 g混合气体中H原子数为6NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA |
5.如图实验能达到实验目的且符合安全要求的是( )
| A. |  制备并检验氢气的可燃性 | B. |  除去CO2中的HCl | ||
| C. |  配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |