题目内容
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)用化学方程式表示B溶液酸性增强的原因 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
(1)Cl2O(2分), 第二周期第VA族 (1分) (2)2HClO=2HCl + O2↑(2分)
(3)3Cl2O +10NH3=6NH4Cl +2N2 + 3H2O (2分) 氧化 (2分)
(4)2Cl2+2Na2CO3+ H2O=Cl2O+2NaHCO3+2NaCl (2分)
(5)取少量晶体溶于水,分成两份于试管中;一份加入浓NOH溶液、加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+;另一份加入用硝酸酸化的硝酸银溶液,产生白色沉淀,证明含Cl-,由此证明该晶体为NH4Cl。(3分,每步1分)
解析试题分析:该气体对空气的相对密度为3.0,则A的相对分子质量是3.0×29=87。又因为含氯化合物A由两种短周期元素组成,氯元素的相对原子质量是35.5,所以该化合物应该含有2个氯原子,则另外一种元素的的相对原子质量是87-35.5×2=16,所以是氧元素,则A的化学式为Cl2O。A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强,所以B是次氯酸。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质,则D是氮气。这说明该反应中氨气被氧化生成氮气,而还原产物是氯化氢,进而与氨气反应生成氯化铵,即C是氯化铵。根据原子守恒可知,E是水。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。因此根据原子守恒可知,该气体应该是氯气,反应的方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl。
(1)气体A的化学式为Cl2O,气体单质D对应元素氮元素在周期表中的位置为第二周期第ⅤA族。
(2)次氯酸不稳定,受热易分解,生成氯化氢和氧气,因此溶液的酸性增强,反应的化学方程式为2HClO=2HCl + O2↑。
(3)二氧化氯具有强氧化性,能把氨气氧化生成氮气,反应的化学方程式为3Cl2O +10NH3=6NH4Cl +2N2 + 3H2O。在反应中氯元素的化合价从+4价降低到-1价,得到电子,被还原,体现二氧化氯的氧化性。
(4)氯气与碳酸钠溶液发生自身的氧化还原反应生成二氧化氯,同时还产生两种盐,因此应该是碳酸氢钠和氯化钠,反应的化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl。
(5)铵盐能与强碱反应生成氨气,氨气能使湿润的红色石蕊试纸显蓝色,据此可以检验NH4+。而氯离子可以通过硝酸酸化的硝酸银溶液检验。即取少量晶体溶于水,分成两份于试管中;一份加入浓NOH溶液、加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+;另一份加入用硝酸酸化的硝酸银溶液,产生白色沉淀,证明含Cl-,由此证明该晶体为NH4Cl。
考点:考查物质推断、元素周期表的结构、氧化还原反应的有关判断与应用以及离子的检验

 名校课堂系列答案
名校课堂系列答案某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
下列有关说法正确的是
| A.步骤I中减少的3g固体一定是混合物 |
| B.步骤II中质量减少的物质一定是Cu |
| C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
| D.根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1 |
根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是 。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水且V的焰色反应为黄色,离子方程式 ;
②V是水,化学方程式为 。
下列有关叙述正确的是( )
A. O和 O和 O中子数相同,质子数不同,互为同位素 O中子数相同,质子数不同,互为同位素 |
| B.H2O比H2S稳定,H—S键比H—O键更难断裂 |
| C.Na2O晶体中存在离子键,是离子化合物 |
| D.Na2O2晶体中阳离子与阴离子个数比为1:1 |
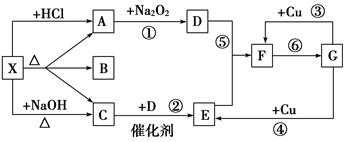
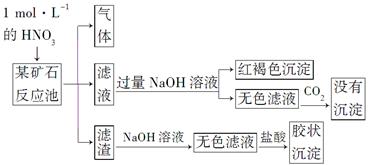
 CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。