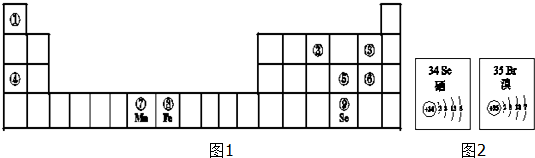
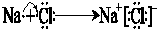
题目内容
9.向100mL NaOH溶液中通入标准状况下的CO2 1.12L后,将溶液小心蒸干后得到不含结晶水的固体5.08g,则下列说法中正确的是( )| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
分析 n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,假设得到的固体是Na2CO3,m(Na2CO3)=106g/mol×0.05mol=5.3g,假设得到的固体是NaHCO3,m(NaHCO3)=0.05mol×84g/mol=4.2g,实际上得到的固体介于二者之间,所以得到的固体是Na2CO3和NaHCO3,
设Na2CO3和NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、固体质量列方程组为
$\left\{\begin{array}{l}{x+y=0.05}\\{106x+84y=5.08}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.04}\\{y=0.01}\end{array}\right.$,
根据Na原子守恒得n(NaOH)=2n(Na2CO3)+n(NaHCO3)=2×0.04mol+0.01mol=0.09mol,
根据C=$\frac{n}{V}$计算氢氧化钠物质的量浓度.
解答 解:n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,假设得到的固体是Na2CO3,m(Na2CO3)=106g/mol×0.05mol=5.3g,假设得到的固体是NaHCO3,m(NaHCO3)=0.05mol×84g/mol=4.2g,实际上得到的固体介于二者之间,所以得到的固体是Na2CO3和NaHCO3,
设Na2CO3和NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、固体质量列方程组为
$\left\{\begin{array}{l}{x+y=0.05}\\{106x+84y=5.08}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.04}\\{y=0.01}\end{array}\right.$,
根据Na原子守恒得n(NaOH)=2n(Na2CO3)+n(NaHCO3)=2×0.04mol+0.01mol=0.09mol,
C(NaOH)=$\frac{n}{V}$=$\frac{0.09mol}{0.1L}$=0.9mol/L,故选D.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,正确判断固体成分是解本题关键,采用极限法、原子守恒来分析解答即可,题目难度不大.

 字词句段篇系列答案
字词句段篇系列答案| A. | 相等 | B. | 前者多于后者 | C. | 后者多于前者 | D. | 无法比较 |
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)
CH3CH2CH2CH2OCH2CH2CH2CH3、CH3CH2CH=CH2.
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是增加乙酸浓度、减小生成物浓度(或移走生成物).
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图2示的操作中,肯定需要的化学操作是ac(选填编号).
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须检查是否漏水
或堵塞(填写操作);某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能分液漏斗上口玻璃塞上的凹槽未与漏斗口上的小孔对准(或漏斗内部未与外界大气相通,或玻璃塞未打开)(写出一点).

 .
.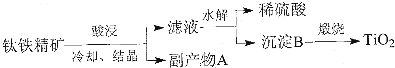
 某同学查阅资料后设计了一条1-丁醇的合成路线:
某同学查阅资料后设计了一条1-丁醇的合成路线: