题目内容
17.1mol NaCl能配成2000mL物质的量浓度为0.5mol/L的NaCl溶液.分析 根据n=cV计算.
解答 解:设溶液的体积为VL,
则VL×0.5mol/L=1mol,
V=2L=2000mL,
故答案为:2000.
点评 本题考查物质的量浓度的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
7.下列各组原子序数所表示的两种元素,不能形成离子键的是( )
| A. | 8和11 | B. | 6和8 | C. | 12和9 | D. | 11和17 |
9.向100mL NaOH溶液中通入标准状况下的CO2 1.12L后,将溶液小心蒸干后得到不含结晶水的固体5.08g,则下列说法中正确的是( )
| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
16.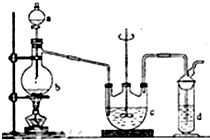 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
(1)b中反应的离子方程式为SO32-+2H+=H2O+SO2↑或HSO3-+H+=SO2↑+H2O,c中试剂为硫化钠和碳酸钠的混合溶液.
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是S.
(3)控制b中的溶液的pH接近7,停止通入SO2.若未控制好pH<7,会影响产率,原因是(用离子方程式表示)S2O32-+2H+=S↓+H2O+SO2↑
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为NaOH溶液.
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)C2H5OH.
(6)实验中要控制SO2生成速率,可采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等;(写出一条)
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点.实验数据如下表:
则该产品的纯度是59.3%,(用百分数表示,保留1位小数)间接碘量法滴定过程中可能造成实验结果偏低的是AB
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
(1)b中反应的离子方程式为SO32-+2H+=H2O+SO2↑或HSO3-+H+=SO2↑+H2O,c中试剂为硫化钠和碳酸钠的混合溶液.
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是S.
(3)控制b中的溶液的pH接近7,停止通入SO2.若未控制好pH<7,会影响产率,原因是(用离子方程式表示)S2O32-+2H+=S↓+H2O+SO2↑
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为NaOH溶液.
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)C2H5OH.
(6)实验中要控制SO2生成速率,可采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等;(写出一条)
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
17.分子式为C8H16O2的有机物A能在酸性条件下水解生成有机物B和C,且B在一定条件下能转化为C,则有机物A可能的结构有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
 X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.
X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.