题目内容
3.某有机分子结构如下:
(1)该分子中最多有13个C原子共处同一平面;
(2)最多有5个C原子共一条直线.
(3)sp杂化的碳原子有2个;sp2杂化的碳原子有8个;具有四面体结构的碳原子有4个.
分析 (1)(2)苯环、碳碳双键为平面结构,碳碳三键为直线结构,以此分析;
(3)碳碳三键中的2个C原子用一个s轨道和一个p轨道进行杂化,形成sp杂化轨道;苯环上的6个C原子、碳碳双键中的2个C原子用一个s轨道和两个p轨道进行杂化,形成sp2杂化轨道;甲基中的3个C原子、CH上的C原子一个s轨道和三个p轨道进行杂化,形成sp3杂化.
解答 解:(1)苯环、碳碳双键为平面结构,碳碳三键为直线结构,则 中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,故答案为:13;
中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,故答案为:13;
(2)苯环上2个C、碳碳三键中2个C、碳碳双键中一个C可以连接成一条线,最对共5个C原子共线,故答案为:5;
(3)碳碳三键中的2个C原子用一个s轨道和一个p轨道进行杂化,形 成两个相等的sp杂化轨道;苯环上的6个C原子、碳碳双键中的2个C原子用一个s轨道和两个p轨道进行杂化,重新组成三个相等的sp2杂化轨道;甲基中的3个C原子、CH上的C原子一个s轨道和三个p轨道进行杂化,形成四个能量相等的杂化轨道,构成四面体结构,
故答案为:2;8;4.
点评 本题主要考查有机化合物的结构特点,难度不大,做题时注意从乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
14.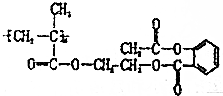 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
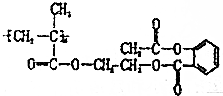 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )| A. | 2.19n g | B. | 2.19g | C. | $\frac{2.92}{n}$g | D. | 2.92g |
18.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是 ( )
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量 变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 热量关系:a+b=92.4 | B. | 三个容器内反应的平衡常数:③>①=② | ||
| C. | 平衡时氨气的体积分数:①=②>③ | D. | ①N2的转化率+②NH3的转化率=100% |
13.能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是( )
| A. | 阿司匹林(乙酰水杨酸) | B. | 青霉素 | ||
| C. | 抗酸药(氢氧化铝) | D. | 麻黄碱 |


 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据