题目内容
13.下列关于氯气的化学性质或实验现象的描述不正确的是( )| A. | 在常温下,氯气与金属铁、铜等难反应 | |
| B. | Fe可在氯气中燃烧,生成棕黄色的烟是FeCl2 | |
| C. | H2在Cl2中燃烧,火焰呈苍白色,并在集气瓶口有白雾出现 | |
| D. | 在做H2、Cl2的光照爆炸实验时,所用的光应当为直射的强光 |
分析 A.氯气与铁、铜反应需要点燃;
B.铁与氯气反应得到高价态的氯化铁;
C.依据氢气与氯气反应现象及生成物的性质解答;
D.依据氢气与氯气在光照条件下发生爆炸解答.
解答 解:A.氯气与铁、铜反应需要点燃,在常温下不反应,故A正确;
B.铁与氯气反应得到高价态的氯化铁,氯化铁为棕黄色固体,故B错误;
C.H2在Cl2中燃烧,火焰呈苍白色火焰,生成的氯化氢极易溶于水,与空气中水蒸气结合形成盐酸小液滴,所以会产生白雾,故C正确;
D.氢气与氯气在光照条件下发生爆炸,在做H2、Cl2的光照爆炸实验时,所用的光应当为直射的强光,故D正确;
故选:B.
点评 本题考查了氯气的性质,熟悉氯气的性质是解题关键,注意氯气与变价金属反应得到高价态氯化物,题目难度不大.

练习册系列答案
相关题目
3.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定含CO32- | |
| B. | 某无色溶液滴入酚酞试液显红色,该溶液呈碱性 | |
| C. | 某溶液中滴加BaCl2溶液生成不溶于稀硝酸的白色沉淀,该溶液可能含有SO42- | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
4.用试纸检验气体性质是一种重要的实验方法,如下表所示的实验中(可加热),下列试纸的选用、现象及对应结论均正确的一项是( )
| 选项 | 试剂 | 湿润的试纸 | 现象 | 结论 |
| A | Na2SO3,浓硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| D | Cu,浓硝酸 | 淀粉-KI试纸 | 变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
1.关于金属性质和原因的描述不正确的是( )
| A. | 金属具有光泽是因为金属阳离子吸收了某些波长的可见光造成的 | |
| B. | 金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电 | |
| C. | 金属具有良好的导热性,是因为自由电子在受热后,加快了运动速率,自由电子通过与金属离子发生碰撞,传递了能量 | |
| D. | 金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键 |
8.已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2↑+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是( )
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为Cl2>Br2>KBrO3>KClO3 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为5:1 | |
| D. | 反应③中1 mol KBrO3参加反应时有10 mol电子转移 |
5.过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 1mol | NA | |
| B | 22.4L | 1mol | |
| C | 212g | 1mol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
2.萜类物质中有许多都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式),关于上述四种香料,下列说法正确的是( )
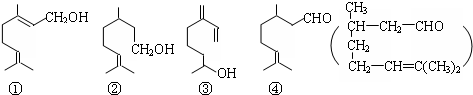

| A. | ④是②的氧化产物 | B. | ①③互为同系物 | ||
| C. | ②③均属于烯烃 | D. | ③④均能发生消去、酯化反应 |
3.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. |  2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |