题目内容
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
【答案】小CH2=CH2 + H2O![]() CH3CH2OH100%D3 2CH3CH2OH + O2
CH3CH2OH100%D3 2CH3CH2OH + O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
(1)乙醇的密度比水小,故答案为:小;
(2)乙烯中含双键可和水发生加成反应生成乙醇,反应方程式为:CH2═CH2+H2O→CH3CH2OH,从方程式可看出,反应物全部转化为生产物,原子利用率为100%,故答案为:CH2═CH2+H2O→CH3CH2OH;100%;
(3)分子式相同结构不同的有机物互称同分异构体,故乙醇的同分异构体为甲醚,故答案为:D;
(4)①46g乙醇的物质的量为:![]() =1mol,C2H5OH+3O2
=1mol,C2H5OH+3O2![]() 2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,故答案为:3;
2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,故答案为:3;
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O2![]() 2CH3CHO+2H2O,故答案为:2C2H5OH+O2
2CH3CHO+2H2O,故答案为:2C2H5OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。

【题目】已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgCl)=1.5×10-16。某研究性学习小组探究AgCl、Ag2S沉淀转化的原因。
步骤 | 现象 |
Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 在空气中放置较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是__。
(2)Ⅱ中能说明沉淀变黑的离子方程式是__。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,沉淀部分溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y中滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是__。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀__。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
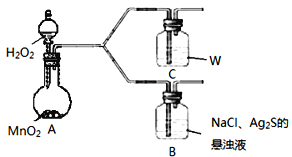
现象 | B:一段时间后,出现乳白色沉淀 |
C:一段时间后,无明显变化 |
①A中产生的气体是___。
②C中盛放的物质W是__。
③该同学认为B中产生沉淀的反应如下(请补充完整):__
2Ag2S+__+__+2H2O=4AgCl+__+4NaOH
④从溶解平衡移动的角度,解释B中NaCl的作用__。