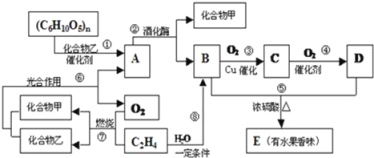
题目内容
【题目】Fe、Ni、Pt在周期表中同族,该族元素的化合物在科学研究和实际生产中有许多重要用途。
(1)①Fe在元素周期表中的位置为________。
②已知FeO晶体晶胞结构如NaCl型,Fe2+的价层电子排布式为________,阴离子的配位数为_______。
③K3[Fe(CN)5NO]的组成元素中,属于第二周期元素的电负性由小到大的顺序是_______。
④把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),该反应的化学方程式为________。
(2)铂可与不同的配体形成多种配合物。分子式为[Pt(NH3)2Cl4]的配合物的配体是______;该配合物有两种不同的结构,其中呈橙黄色的物质的结构比较不稳定,在水中的溶解度大;呈亮黄色的物质的结构较稳定,在水中的溶解度小,下图图1所示的物质中呈亮黄色的是______(填“A”或“B”),理由是________。

(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如上图图2所示。储氢原理为:镧镍合金吸咐H2,H2解离为H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱心和上下底面的面心,则形成的储氢化合物的化学式为_______。
【答案】第四周期Ⅷ族 3d6 6 C<N<O 2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl NH3、Cl- A A的结构对称程度高,较稳定,为非极性分子,根据相似相溶原理,A在水中的溶解度小 LaNi5H3
【解析】
(1)①Fe是26号元素,根据核外电子排布规律,结合原子结构与元素在周期表的位置判断其位置;
②Fe2+是Fe原子失去2个电子形成的,根据原子的构造原理可得其价层电子排布式;
③K3[Fe(CN)5NO]的组成元素中,属于第二周期元素有C、N、O,根据元素的非金属性越强,其电负性就越大分析比较元素的电负性的大小;
④氯气有氧化性,会把黄血盐(K4[Fe(CN)6])氧化为得到赤血盐(K3[Fe(CN)6]);
(2)分子式为Pt(NH3)2Cl4的配合物的配体是NH3、Cl-;
结构对称正负电荷中心重合的A为非极性分子、正负电荷中心不重合的B为极性分子,水是极性分子,极性分子的溶质易溶于极性分子的溶剂;
(3)用均摊法计算每个晶胞中含有的各种元素的原子个数,得到其化学式。
(1)①Fe是26号元素,核外电子排布是2、8、14、2,因此其在元素周期表的位置是第四周期第VIII族;
②Fe2+是Fe原子失去2个电子形成的,根据原子的构造原理可得Fe2+的核外电子排布式是1s22s22p63s23p63d6,所以其价层电子排布式为3d6;FeO晶体晶胞结构如NaCl型,在O2-周围距离相等且最近的有6个Fe2+,在Fe2+周围距离相等且最近的有6个O2-,所以O2-的配位数是6;
③在K3[Fe(CN)5NO]的组成元素中,属于第二周期元素有C、N、O,由于元素的非金属性越强,其电负性就越大,元素的非金属性O>N>C,所以元素的电负性由小到大的顺序是C<N<O;
④氯气有氧化性,会把黄血盐(K4[Fe(CN)6])氧化为得到赤血盐(K3[Fe(CN)6]),该反应的化学方程式为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl;
(2)根据图1,可知该物质的配体为NH3和Cl-,橙黄色在水中的溶解度较大,水为极性分子,根据相似相溶,橙黄色也为极性分子,A为对称结构,属于非极性分子;B为非对称结构,属于极性分子,则橙黄色的配合物为B,亮黄色的为A;
(3)根据晶胞结构,可用均摊法计算其化学式,La:8![]() =1,Ni的原子个数为8
=1,Ni的原子个数为8![]() +1=5,H原子的个数为8
+1=5,H原子的个数为8![]() +2
+2![]() =3,所以其化学式为LaNi5H3。
=3,所以其化学式为LaNi5H3。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

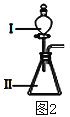
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。
【题目】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。

若图示中表示反应 H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为___________________________________。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的能量变化为______________。