题目内容
16.由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol.若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+$\frac{1}{2}$O2(g)=H2O(l)的△H=-285.5 kJ/mol.氢气的燃烧热为285.5kJ/mol.分析 根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热.
解答 解:氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+$\frac{1}{2}$O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+44kJ/mol)=-285.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;-285.5;285.5.
点评 本题考查热化学方程式的书写与反应热的计算,难度不大,注意掌握热化学方程式的书写,物质聚集状态的分析判断,盖斯定律的计算应用,题目较简单.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.下列实验的有关叙述错误的是( )
| 选项 | A | B | C | D |
| 实验装置图 |  | 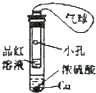 |  | 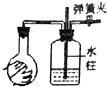 |
| 实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
| 实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
11.下列各组离子中,在溶液中能大量共存的是( )
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
1.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
8.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:
(1)能形成共价键的元素有H、He、C、N、O、F、S、Cl元素,共8种.
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.
5.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA | |
| C. | 常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA | |
| D. | 在1 L 1.0 mol•L-1碳酸钠溶液中,阴离子总数大于NA |
6. 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如下:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如下:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O
 Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2
 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.