题目内容
15.下列说法正确的是( )| A. | CaCl2、NaOH、HCl、HD四种物质均属于化合物 | |
| B. | 明矾和漂白粉常分别用于自来水的净化和杀菌消毒,两者作用原理不同 | |
| C. | 工业上都采用电解氯化物的方法来制取钠、镁和铝 | |
| D. | SiO2既能与HF反应又能和NaOH反应,所以SiO2属于两性氧化物 |
分析 A.HD为氢气单质;
B.明矾中铝离子水解生成胶体,而漂白粉中ClO-具有强氧化性;
C.工业上采用电解熔融氯化物的方式制取钠、镁,用电解氧化铝来制取铝;
D.二氧化硅是酸性氧化物能和强碱反应,但也能和特殊的酸氢氟酸反应.
解答 解:A.HD为氢气单质,不是化合物,故A错误;
B.明矾中铝离子水解生成胶体,具有吸附性可净化水,而漂白粉中ClO-具有强氧化性,用于水的杀菌消毒,二者原理不同,故B正确;
C.氯化铝是共价化合物,所以熔融时,它是不导电的,所以只能去电解氧化铝,因为氧化铝才是离子化合物,熔融时才导电,故C错误;
D.二氧化硅是酸性氧化物能和强碱反应,反应方程式为SiO2+2NaOH═Na2SiO3+H2O;但也能和特殊的酸氢氟酸反应,反应方程式为:SiO2+4HF═SiF4↑+2H2O,但二氧化硅属于酸性氧化物,故D错误.
故选B.
点评 本题考查元素及其化合物的综合应用,为高频考点,注重物质的性质及化学与生活的考查,把握物质的性质及发生的反应即可解答,题目难度不大.

练习册系列答案
相关题目
6.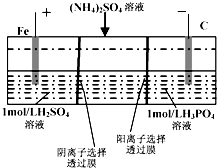 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
3.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 常温下,1mol Cu与足量的该硫酸反应产生2g氢气 | |
| C. | 等质量的水与该硫酸混合所得溶液的物质的量浓度小于9.2mol/L | |
| D. | 配制240mL 4.6mol/L的稀硫酸需取该硫酸60mL |
10.下列表示物质结构的化学用语或模型图正确的是( )
| A. | H2O2的电子式: | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |
20.硫酸铜溶液可以解除白磷引起的中毒,有关反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法不正确的是( )
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
7.下列有关物质性质和应用都正确的是( )
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 明矾净水是因为Al(OH)3胶体能消毒 | |
| C. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 | |
| D. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
4.氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗.纯化工业级氧化锌[含
有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO$→_{①}^{稀H_{2}SO_{4}}$ 浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$ $\stackrel{过滤}{→}$ 滤液$→_{③}^{Zn}$ $\stackrel{过滤}{→}$滤液 $→_{④}^{Na_{2}CO_{3}}$ 滤饼$→_{⑤}^{煅烧⑤}$ZnO
已知:a.在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2;
b.Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
回答下列问题:
(1)反应②中除掉的杂质离子是Fe2+、Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;在加高锰酸钾溶液之前,若pH较低,对除杂的影响是铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)反应③的反应类型为置换反应(填“化合反应”、“分解反应”、“置换反应”或“复分解反应”),过滤得到的滤渣中,除了过量的锌外还有镍;
(3)反应④形成的沉淀要用水洗,检验沉淀已洗涤干净的方法是取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2,取干燥后的滤饼22.4g,煅烧后可得到产品16.2g.则x等于1.
有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO$→_{①}^{稀H_{2}SO_{4}}$ 浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$ $\stackrel{过滤}{→}$ 滤液$→_{③}^{Zn}$ $\stackrel{过滤}{→}$滤液 $→_{④}^{Na_{2}CO_{3}}$ 滤饼$→_{⑤}^{煅烧⑤}$ZnO
已知:a.在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2;
b.Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 |
(1)反应②中除掉的杂质离子是Fe2+、Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;在加高锰酸钾溶液之前,若pH较低,对除杂的影响是铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)反应③的反应类型为置换反应(填“化合反应”、“分解反应”、“置换反应”或“复分解反应”),过滤得到的滤渣中,除了过量的锌外还有镍;
(3)反应④形成的沉淀要用水洗,检验沉淀已洗涤干净的方法是取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2,取干燥后的滤饼22.4g,煅烧后可得到产品16.2g.则x等于1.
5.下列溶液中,物质的量浓度最大的是( )
| A. | 1LH2SO4溶液中含98gH2SO4 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1L含196gH2SO4的溶液 |