题目内容
取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L.则参加反应的HCl的物质的量为________.
2mol
分析:反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,结合化学方程式计算.
MnCl2+Cl2↑+2H2O,结合化学方程式计算.
解答:n(Cl2)=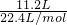 =0.5mol,
=0.5mol,
反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
则消耗的HCl为0.5mol×4=2mol,
故答案为:2mol.
点评:本题考查化学方程式的计算,题目难度不大,注意反应的化学方程式的书写.
分析:反应的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,结合化学方程式计算.
MnCl2+Cl2↑+2H2O,结合化学方程式计算.解答:n(Cl2)=
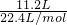 =0.5mol,
=0.5mol,反应的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,则消耗的HCl为0.5mol×4=2mol,
故答案为:2mol.
点评:本题考查化学方程式的计算,题目难度不大,注意反应的化学方程式的书写.

练习册系列答案
相关题目
