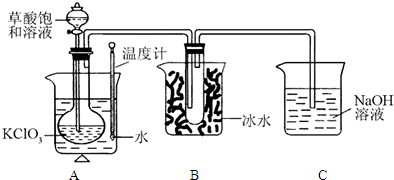
题目内容
某同学查资料得到α-AgI是一种固体导体,导电率很高。固体导体导电的原理是构成离子晶体的某一离子在晶体孔隙中自由移动。他为了研究α-AgI究竟是Ag+导电还是I-导电,设计一个如下图所示(用铝蓄电池做电源)的电化学实验。已知铅蓄电池总反应:Pb+PbO2+2H2SO4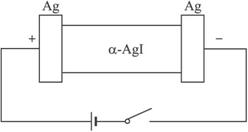
(1)铅蓄电池的正极电极方程式:(已知硫酸铅为难溶物)
____________________________________________________________________。
(2)若Ag+导电,α-AgI本身质量将____________(填“不变”“变大”或“变小”),电解池的阳极电极方程式:____________________________。
若I-导电,阳极附近的α-AgI晶体密度将会____________(填“不变”“变大”或“变小”)。
(3)若通电一段时间后铅蓄电池中消耗了1 mol H2SO4,则电解池的阴极增重____________ g。
(1)PbO2+4H++![]() +2e-====PbSO4+2H2O
+2e-====PbSO4+2H2O
(2)不变 Ag-e-====Ag+ 变大 (3)108
解析:(1)铅蓄电池放电反应中的氧化剂为PbO2,其在原电池正极上发生得电子的还原反应,据此可写出正极电极反应式为PbO2+4H++![]() +2e-====PbSO4+2H2O。(2)阳极电极反应式为Ag-e-
+2e-====PbSO4+2H2O。(2)阳极电极反应式为Ag-e-![]() Ag+,阴极电极反应式为Ag++e-
Ag+,阴极电极反应式为Ag++e-![]() Ag,由此可知。若Ag+导电,α-AgI中Ag+得失守恒,α-AgI本身质量将不变。若I-导电,I-移动至阳极后与此处生成的Ag+反应生成AgI,导致阳极附近的α-AgI晶体密度变大。(3)据电子得失守恒得关系式:
Ag,由此可知。若Ag+导电,α-AgI中Ag+得失守恒,α-AgI本身质量将不变。若I-导电,I-移动至阳极后与此处生成的Ag+反应生成AgI,导致阳极附近的α-AgI晶体密度变大。(3)据电子得失守恒得关系式:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O—2e-—2Ag
2PbSO4+2H2O—2e-—2Ag
2 mol 2×
1 mol 108 g

碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将 KI 和 KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。
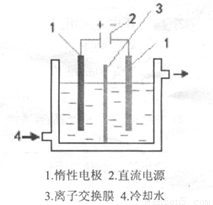
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
|
实验操作 |
现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到KIO3晶体的过程为:
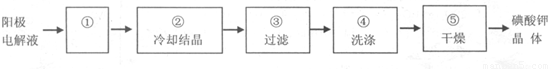
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
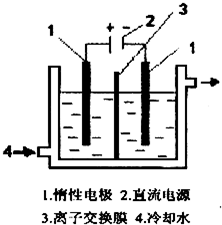 碘酸钾(KlO3)晶体是我国规定的食盐加碘剂.它 通常是以碘为原料与过量KOH溶液通过下列反应制 得:3I2+6K0H=5KI+KI03+3H20,再将 KI 和 KIO3 的混 合溶液电解,将其中的I-转化为IO-3,装置如图.
碘酸钾(KlO3)晶体是我国规定的食盐加碘剂.它 通常是以碘为原料与过量KOH溶液通过下列反应制 得:3I2+6K0H=5KI+KI03+3H20,再将 KI 和 KIO3 的混 合溶液电解,将其中的I-转化为IO-3,装置如图.