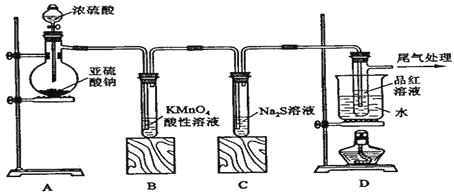
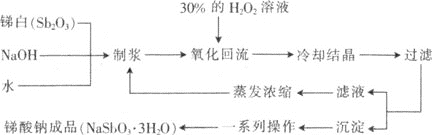
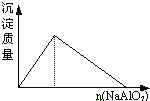
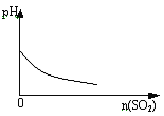
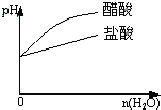
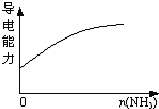
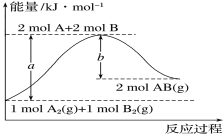
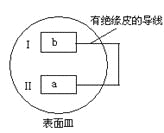
题目内容
【题目】某有机物样品3 g充分燃烧后,得到4.4 g CO2和1.8 g H2O ,实验测得其相对分子质量为60,求该有机物的分子式。
【答案】C2H4O2
【解析】
先计算CO2、H2O的物质的量,得到C、H的物质的量,然后计算其中含有C、H的质量,用总质量减去C、H质量就是O元素的质量,得到C、H、O的质量比及物质的量的比,可得最简式,然后根据最简式的式量、相对分子质量关系,得到物质的分子式。
有机物燃烧产生CO2的物质的量为n(CO2)=![]() =0.1 mol,n(C)= n(CO2)=0.1mol,则m(C)=0.1 mol×12 g/mol=1.2 g;有机物燃烧产生H2O的物质的量为n(H2O)=
=0.1 mol,n(C)= n(CO2)=0.1mol,则m(C)=0.1 mol×12 g/mol=1.2 g;有机物燃烧产生H2O的物质的量为n(H2O)=![]() =0.1 mol,n(H)=2n(H2O)=2×0.1 mol=0.2 mol,则m(H)=0.2 mol×1 g/mol=0.2 g,m(C)+m(H)=1.2 g+0.2 g=1.4 g<3 g,说明有机物中含有O原子,其质量m(O)=3 g-1.2 g-0.2 g=1.6 g,所以n(O)=
=0.1 mol,n(H)=2n(H2O)=2×0.1 mol=0.2 mol,则m(H)=0.2 mol×1 g/mol=0.2 g,m(C)+m(H)=1.2 g+0.2 g=1.4 g<3 g,说明有机物中含有O原子,其质量m(O)=3 g-1.2 g-0.2 g=1.6 g,所以n(O)=![]() =0.1 mol;n(C):n(H):n(O)=0.1:0.2:0.1=1:2:1,物质最简式是CH2O,最简式的式量是30,设物质分子式是(CH2O)n,该物质相对分子质量是60,30n=60,所以n=2,故该物质分子式是C2H4O2。
=0.1 mol;n(C):n(H):n(O)=0.1:0.2:0.1=1:2:1,物质最简式是CH2O,最简式的式量是30,设物质分子式是(CH2O)n,该物质相对分子质量是60,30n=60,所以n=2,故该物质分子式是C2H4O2。

练习册系列答案
相关题目