题目内容
【题目】(1)可逆反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0,在其他条件不变时,
2SO3(g);ΔH<0,在其他条件不变时,
①升温反应速率________,增大压强反应速率________;
②达到化学平衡时,v正(SO2)________(填“大于”“小于”或“等于”)v逆(SO3);若平衡后增加O2的浓度,平衡向________方向移动,SO2的转化率________;若升高温度,则平衡向________方向移动。
(2)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了![]() nmol,C增加了
nmol,C增加了![]() nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
【答案】增大 增大 等于 正反应 增大 逆反应 2 1 3 2
【解析】
(1)①升高温度、增大压强,反应速率都增大;
②达到平衡时,正反应速率=逆反应速率;增大反应物浓度,平衡正向移动,另一个反应物的转化率增大;升高温度,平衡向吸热反应的方向移动;
(2)同一反应同一时间段内,参加反应的各物质的物质的量之比等于其化学计量数之比。
(1)①无论反应是放热反应或吸热反应,升高温度,反应速率均增大;对于有气体参与的反应,增大压强,反应速率增大;
②达到平衡后,各组成的浓度不再改变,则v正(SO2)等于v逆(SO3);增大反应物的浓度,平衡向正反应方向移动,另一个反应物消耗更多,则SO2的转化率增大;该反应正反应为放热反应,若升高温度,平衡向着反应吸热方向移动,即向逆反应方向移动;
(2)同一反应同一时间段内,参加反应的各物质的物质的量之比等于其化学计量数之比,则
![]() ,则:a=2,b=1,c=3,d=2。
,则:a=2,b=1,c=3,d=2。

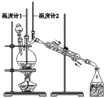
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇