题目内容
(2013?江苏三模)用下列实验装置进行相应实验,能达到实验目的是( )

分析:A.二氧化硫易溶于水,溶于水导致气体压强急剧降低而引起倒吸现象,所以有缓冲装置时就能防止倒吸,即适合吸收二氧化硫气体;
B.容量瓶是配制一定物质的量浓度的溶液的专用仪器,不能作为稀释的容器;
C.因为溴与溴苯都溶于四氯化碳,所以不能用四氯化碳除去溴苯中少量的溴,正确方法为用碱和溴反应,碱与溴苯不反应,产物与溴苯不互溶;
D.氨气密度比空气小,应用向下排空气法收集.
B.容量瓶是配制一定物质的量浓度的溶液的专用仪器,不能作为稀释的容器;
C.因为溴与溴苯都溶于四氯化碳,所以不能用四氯化碳除去溴苯中少量的溴,正确方法为用碱和溴反应,碱与溴苯不反应,产物与溴苯不互溶;
D.氨气密度比空气小,应用向下排空气法收集.
解答:解:A.倒置球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用而防止倒吸,二氧化硫易溶于水且能与氢氧化钠反应,所以能用图Ⅰ所示装置吸收尾气中的二氧化硫,故A正确;
B.容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,瓶上标有刻度、并标有容量;容量瓶对溶液的体积精确度要求较高,只能在常温下使用,瓶上标有使用温度,一般为25℃,浓硫酸稀释放热,所以不能将浓硫酸直接在容量瓶中稀释,故B错误;
C.四氯化碳是有机溶剂,既可以溶解苯,又可以溶解溴,所以不能用四氯化碳除去溴苯中少量的溴,正确方法为用氢氧化钠,2NaOH+Br2═NaBr+NaBrO+H2O,NaBr和NaBrO与溴苯不互溶,所以向分液漏斗中加入少量氢氧化钠溶液,振荡,分液即可,故C错误;
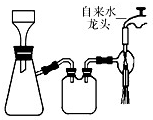
D.浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,制得氨气,所以能用图中的左图部分制备,由于氨气的密度比空气的平均密度小,只能用向下排空气法收集,而图中的收集装置为向上排空气法,故D错误;
故选A.
B.容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,瓶上标有刻度、并标有容量;容量瓶对溶液的体积精确度要求较高,只能在常温下使用,瓶上标有使用温度,一般为25℃,浓硫酸稀释放热,所以不能将浓硫酸直接在容量瓶中稀释,故B错误;
C.四氯化碳是有机溶剂,既可以溶解苯,又可以溶解溴,所以不能用四氯化碳除去溴苯中少量的溴,正确方法为用氢氧化钠,2NaOH+Br2═NaBr+NaBrO+H2O,NaBr和NaBrO与溴苯不互溶,所以向分液漏斗中加入少量氢氧化钠溶液,振荡,分液即可,故C错误;
D.浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,制得氨气,所以能用图中的左图部分制备,由于氨气的密度比空气的平均密度小,只能用向下排空气法收集,而图中的收集装置为向上排空气法,故D错误;
故选A.
点评:本题考查了二氧化硫尾气处理、容量瓶的使用、除去溴苯中少量的溴,氨气的制取和收集等知识,做题时要充分考虑物质的性质,认真分析实验装置图的特点是解题的关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: